Đề số 4 - Đề kiểm tra học kì 2 - Hóa học 11
Đáp án và lời giải chi tiết Đề số 4 - Đề kiểm tra học kì 2 (Đề thi học kì 2) - Hóa học 11
Đề bài
I. PHẦN TRẮC NGHIỆM
Câu 1. Công thức cấu tạo nào sau đây là phù hợp với tên gọi: 1-brom-2-clo-3-mrtylpentan?
\(\begin{array}{l}A.C{H_2}Cl - CHBr - CH\left( {C{H_3}} \right) - C{H_2} - C{H_3}.\\B.C{H_2}Br - CHCl - CH\left( {C{H_3}} \right) - C{H_2} - C{H_3}.\\C.C{H_2}Br - CHCl - C{H_2} - CH\left( {C{H_3}} \right) - C{H_3}.\\D.C{H_3} - C{H_2}Br - CHCl - CH\left( {C{H_3}} \right) - C{H_3}.\end{array}\)
Câu 2. Cho công thức cấu tạo của một hợp chất như sau:
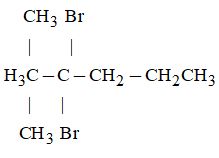
Công thức trên ứng với tên gọi nào sau đây?
A.4,4-đibrom-5,5-đimetylhexxan.
B.3,3- đibrom-2,2-đimetylhexxan.
C. 4,4-đibrom-3,3-đimetylhexxan.
D. 4,4-đibrom-3,3-đimetylheptan.
Câu 3. Cho X, Y, Z là các hiđrocacbon ở thể khí, khi phân hủy mỗi chất X, Y, Z đều thu được thể tích H2 gấp 3 lần thể tích hiđrocacbon bị phân hủy. Biết rằng X, Y, Z không phải là đồng phân. Công thức phân tử của ba chất trên lần lượt là:
A. CH4; C2H4; C3H4.
B. C2H6; C3H6; C4H6.
C. C2H4; C3H8; C4H10.
D. C3H6; C2H2; C2H4.
Câu 4. Cho 3,5 gam một anken (X) tác dụng với dung dịch KMnO4 loãng dư, thu được 5,2 gam sản phẩm hữu cơ. Vậy (X) có công thức phân tử là:
A. C2H4.
B. C3H8.
C. C4H8.
D. C5H10.
Câu 5. Khi hóa hơi một hiđrocacbon (X) ở thể lỏng thì có tỉ khối hơi đối với không khí bằng 2,69. Đốt cháy hoàn toàn (X) thu được CO2 và H2O theo tỉ lệ khối lượng là 4,89 : 1. Công thức phân tử của (X) là:
A. C6H6. B. C7H8.
C. C8H8. D. C9H12.
Câu 6. Phân tích hai hợp chất hữu cơ (X) và (Y) thì chúng đều có: %C = 92,3%; %H = 7,7%. Tỉ khối hơi của (X) đối với H2 bằng 13. Ở đktc, khối lượng của 1 lít (Y) nặng 3,48 gam. Công thức phân tử của (X), (Y) lần lượt là:
A. C2H2 và C6H6.
B. C6H6 và C6H12.
C. C6H6 và C7H8.
D. C6H6 và C8H8.
Câu 7. Khi đốt cháy hoàn toàn một ancol đơn chức (Z) thu được CO2 và hơi nước theo tỉ lệ thể tích là 4 : 5. Công thức phân tử của (Z) là:
A. C3H8O.
B. C4H10O.
C. C2H6O.
D. C5H12O.
Câu 8. Oxi hóa hoàn toàn môt ancol đa chức (X) thu được CO2 và hơi nước theo tỉ lệ khối lượng là 44 : 27. Công thức phân tử ancol (X) là:
A. C5H10O2. B. C4H8O2.
C. C3H8O2. D. C2H6O2.
Câu 9. Cho 0,75 gam hỗn hợp gồm các ancol tác dụng với natri (vừa đủ) thu được 1,008 lít H2 (đktc). Khối lượng của muối natri thu được là:
A. 2,91 gam. B. 2,82 gam.
C. 2,73 gam. D. 1,875 gam.
Câu 10. Lấy 1,74 gam một anđehit no đơn chức tác dụng hết với dung dịch AgNO3/NH3 thu được 6,48 gam bạc. Công thức phân tử của anđehit đem dùng là:
A. C2H5CHO. B. C3H7CHO.
C. C4H9CHO. D. HCHO.
Câu 11. Để trung hòa 1,18 gam một axit cacboxylic (Y) cần 40ml dung dịch NaOH 0,5M. Công thức cấu tạo của (Y) là:
\(\begin{array}{l}A.HOOC - {C_2}{H_4} - COOH.\\C.C{H_3}COOH.\end{array}\) \(\begin{array}{l}B.HOOC - C{H_2} - COOH.\\D.HOOC - COOH.\end{array}\)
Câu 12. Tiến hành oxi hóa 4 gam ancol metylic để chỉ chuyển thành anđehit, sau đó hòa tan hết vào 5 gam nước. Hiệu suất phản ứng oxi hóa là 80%. Nồng độ của anđehit trong dung dịch thu được là:
A. 25%. B. 50%
C. 35,5% D.37,5%.
II. PHẦN TỰ LUẬN
Câu 13. Đốt cháy 8,96 lít hỗn hợp X gồm 2 anken A, B đồng đẳng kế tiếp thì thấy khối lượng CO2 lớn hơn khối lượng H2O là 39 gam.
a)Xác định công thức phân tử của A, B.
b)Tính thành phần phần trăm theo thể tích của mỗi khí trong hỗn hợp X.
Câu 14. Dẫn 5,6 lít một ankin X đồng đẳng với axetilen vào dung dịch AgNO3/NH3 dư thu được 36,75 gam kết tủa màu vàng nhạt. Xác định công thức phân tử của ankin X đem dùng.
Câu 15. Phân tích một hợp chất hữu cơ Y chỉ chứa C, H, O thu được mC + mH = 3,5mO. Hỏi công thức đơn giản nhất của Y là gì?
Câu 16. Cho ba dung dịch đựng trong ba ống nghiệm là: ancol etylic, anđehit axetic và glixerol. Bằng phương pháp hóa học, hãy nhận biết các dung dịch trên.
Lời giải chi tiết
I. PHẦN TRẮC NGHIỆM
|
Câu |
1 |
2 |
3 |
4 |
|
Đáp án |
B |
B |
B |
D |
|
Câu |
5 |
6 |
7 |
8 |
|
Đáp án |
A |
A |
B |
D |
|
Câu |
9 |
10 |
11 |
12 |
|
Đáp án |
C |
A |
A |
D |
II. PHẦN TỰ LUẬN
Câu 13.
a) Xác định công thức phân tử (A), (B):
Gọi công thức tương đương của hai anken là: \({C_{\overline n }}{H_{2\overline n }}\)
Ta có: \({n_X} = \dfrac{{8,96}}{{22,4}} = 0,4\left( {mol} \right)\)
Theo đề bài: \({m_{C{O_2}}} - {m_{{H_2}O}} = 39\)
\( \Leftrightarrow 0,4\overline n .44 - 0,4\overline n .18 = 39\)
\(\Rightarrow \overline n = 3,75\)
Vì A, B là hai anken đồng đẳng kế tiếp nhau nên anken A là: C3H6 và anken B: C4H8.
b) Tính phần trăm theo thể tích của các khí trong X:
Gọi a là số mol C3H6 và b là số mol C4H8
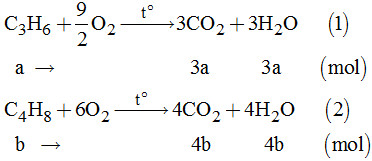
Theo đề bài, ta có hệ phương trính:
\(\left\{ \begin{array}{l}a + b = 0,4\\3a + 4b = 1,5\end{array} \right. \Rightarrow \left\{ \begin{array}{l}a = 0,1\\b = 0,3\end{array} \right.\)
Vì là chất khí nên %V = %n
Vậy: \(\% {V_{{C_3}{H_6}}} = \% {n_{{C_3}{H_6}}} = \dfrac{{0,1}}{{0,4}} \times 100\% \)\(\, = 25\% \)
\(\% {V_{{C_4}{H_8}}} = \% {n_{{C_4}{H_8}}} = 100\% - 25\% \)\(\, = 75\% .\)
Câu 14. Ta có: \({n_{ankin}} = \dfrac{{5,6}}{{22,4}} = 0,25\left( {mol} \right)\)
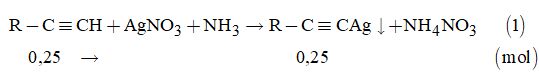
Theo đề bài, ta có phương trình:
\(0,25\left( {R + 108 + 24} \right) = 36,75 \)
\(\Rightarrow R = 15:\) gốc CH3-
Công thức phân tử: \(C{H_3} - C \equiv CH\).
Câu 15.
Gọi công thức chất hữu cơ Y có dạng: CxHyOz.
Theo đề bài, ta có: \(12x + y = 3,5 \times 16z\)
+ Chọn \(z = 1 \Rightarrow 12x + y = 56 \Rightarrow \left\{ \begin{array}{l}x = 4\\y = 8\end{array} \right.\)
\( \Rightarrow CTPT:{C_4}{H_8}O\)
+ Chọn \(z = 2 \Rightarrow 12x + y = 112 \Rightarrow \left\{ \begin{array}{l}x = 8\\y = 16\end{array} \right.\)
\( \Rightarrow CTPT(X):{C_8}{H_{16}}{O_2}\)
Vậy công thức đơn giản nhất của Y là: C4H8O.
Câu 16.
Trích mỗi dung dịch một ít làm mẫu thử.
Cho Cu(OH)2 lần lượt vào các mẫu thử đun nóng.
+ Mẫu thử tạo kết tủa đỏ gạch (Cu2O) là anđehit axetic.
+ Mẫu thử tạo dung dịch màu xanh là glixerol.
+ Mẫu thử không có hiện tượng gì là ancol etylic.
Search google: "từ khóa + timdapan.com" Ví dụ: "Đề số 4 - Đề kiểm tra học kì 2 - Hóa học 11 timdapan.com"







