Đề số 1 - Đề kiểm tra học kì 2 - Hóa học 11
Đáp án và lời giải chi tiết Đề số 1 - Đề kiểm tra học kì 2 (Đề thi học kì 2) - Hóa học 11
Đề bài
I. PHẦN TRẮC NGHIỆM
Câu 1. Đốt cháy hết 8,8 gam hỗn hợp hai ankan X, Y ở thể khí thu được 13,44 lít khí CO2 (đktc), biết thể tích hai ankan trong hỗn hợp bằng nhau. Vậy X, Y có công thức phân tử là:
A.C2H6 và C4H10.
B.C2H6 và C3H8.
C.CH4 và C2H6.
D.C3H8 và C4H10.
Câu 2. Đốt cháy hoàn toàn 3,36 lít một ankan khí (X) (đktc), thu được 13,2 gam khí CO2. Công thức phân tử của (X) là:
A.CH4.
B.C4H10.
C.C3H8.
D.C2H6.
Câu 3. Cho công thức phân tử của hiđrocacbon (X) là C5H8, biết hiđro hóa (X), thu được isopentan và X có khả năng trùng hợp. Công thức cấu tạo của (X) là:
\(\begin{array}{l}A.C{H_2} = C = C{\left( {C{H_3}} \right)_2}\\C.C{H_3} - C{H_2} - C{H_2} - C \equiv CH\\B.C{H_2} = C\left( {C{H_3}} \right) - CH = C{H_2}\\D.C{H_3} - C{H_2} - C \equiv C - C{H_3}\end{array}\)
Câu 4. Cho 6,65 gam hỗn hợp (X) gồm CH4 và hai anken đồng đảng liên tiếp nhau qua dung dịch brom dư thấy khối lượng bình tăng 4,41 gam và thể tích hỗn hợp (X) giảm đi một nửa. Công thức phân tử của hai anken trong (X) là:
A.C2H4 và C3H6.
B.C3H6 và C4H8.
C.C2H6 và C3H8.
D.C4H8 và C5H10.
Câu 5. Có ba ống nghiệm đựng 3 chất lỏng: etylbenzen, vinylbenzen và phenolaxetilen. Dùng phương pháp hóa học nào sau đây để nhận biết các chất trên?
A.Dùng quỳ tím, sau đó cho NaOH.
B.Dùng dung dịch brom, sau đó dùng dung dịch AgNO3/NH3.
C.Dùng dung dịch NaCl và KOH.
D.Cả A, B và C đều đúng.
Câu 6. Khi cho benzen dư phản ứng với propyl clorua có xúc tác \(AlC{l_3}/t^\circ \) thì sản phẩm chính thu được là:
A.\({C_6}{H_5} - CH{\left( {C{H_3}} \right)_2}\)
B.\({C_6}{H_5} - C{H_2} - C{H_2} - C{H_3}\)

Câu 7. Đốt cháy hoàn toàn 11 gam hỗn hợp ancol metylic và ancol etylic thì thu được 4,48 lít CO2 ở \(0^\circ C\) và 2atm. Khối lượng của ancol etylic là bao nhueeu?
A. 4,6 gam. B. 6,4 gam.
C. 3,2 gam. D. 4,0 gam.
Câu 8. Ancol etylic phản ứng được với chất nào sau đây (có xúc tác)?
A. CH3COOH. B. Zn.
C. Cu(OH)2. D. CaCO3.
Câu 9. Khi làm bay hơi 15 gam một ancol no, đơn chức thì thu được thể tích bằng thể tích của 8 gam oxi đo ở cùng điều kiện. Công thức phân tử của ancol trên là:
A. CH4O. B. C2H6O.
C. C3H8O. D.C4H10O.
Câu 10. Cho chuỗi biến đổi sau:
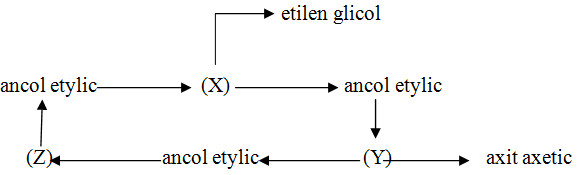
Vậy X, Y, Z lần lượt là:
\(\begin{array}{l}A.{C_2}{H_5}Br;{\rm{ C}}{{\rm{H}}_3}CHO;{\rm{ C}}{{\rm{H}}_3}COOH.\\B.C{H_3}CHO;{\rm{ C}}{{\rm{H}}_3}COOH;{\rm{ }}{{\rm{C}}_2}{H_6}.\\C.C{H_3}COO{C_2}{H_5};{\rm{ }}{{\rm{C}}_2}{H_5}Cl;{\rm{ C}}{{\rm{H}}_3}CHO.\\D.{C_2}{H_4};{\rm{ C}}{{\rm{H}}_3}CHO{\rm{; }}{{\rm{C}}_2}{H_5}Cl.\end{array}\)
Câu 11. Nhựa novolac (phenol-fomanđehit) được điều chế bằng cách đun nóng phenol dư với chất nào sau đây trong môi trường axit?
A. CH3CHO. B. CH3COOH.
C. HCHO. D. HCOOH.
Câu 12. Cho m gam hỗn hợp (X) gồm HCOOH và C2H5OH tác dụng hoàn toàn với Na thu được 3,36 lít khí H2. Giá trị của m là:
A. 12 gam. B. 13,8 gam.
C. 14 gam. D. 15 gam.
II. PHẦN TỰ LUẬN
Câu 13. Hỗn hợp X gồm etan và propan.
a)Đốt cháy một ít hỗn hợp X thì thu được khí CO2 và hơi nước theo tỉ lệ thể tích \(\dfrac{{11}}{{15}}\). Tính % theo thể tích mỗi chất trong hỗn hợp X.
b)Đun nóng một ít hỗn hợp X trong bình kín có mặt chất xúc tác để thực hiện phản ứng đehiđro hóa (tách hiđro) ta thu được sản phẩm là hỗn hợp hiđrcacbon và hiđro có tỉ khối so với hiđro là 13,5. Tính hiệu suất phản ứng đehiđro hóa, cho biết etan và propan bị đehiđro hóa với hiệu suất như nhau và chỉ tạo ra anken.
Câu 14. Chia hỗn hợp ankin X thành hai phần bằng nhau. Đem đốt cháy phần thứ nhất thu được 0,896 lít khí CO2 (đktc) và 0,54 gam H2O. Phần thứ hai tác dụng với dung dịch brom. Tính khối lượng brom đã tham gia phản ứng.
Câu 15. Đốt cháy hoàn toàn 11,9 gam hỗn hợp C2H2 và C3H4, thu được 20,16 lít CO2 (đktc). Tính thành phần phần trăm theo khối lượng của mỗi khí trong hỗn hợp ban đầu.
Câu 16. Cho công thức nguyên của anđehit no mạch hở X là (C2H3O)n. Xác định công thức phân tử của X.
Lời giải chi tiết
I. PHẦN TRẮC NGHIỆM
|
Câu |
1 |
2 |
3 |
4 |
|
Đáp án |
A |
D |
B |
A |
|
Câu |
5 |
6 |
7 |
8 |
|
Đáp án |
B |
B |
A |
A |
|
Câu |
9 |
10 |
11 |
12 |
|
Đáp án |
C |
D |
C |
B |
II. PHẦN TỰ LUẬN
Câu 13.
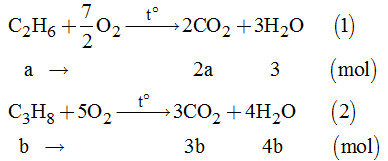
Theo đề bài, ta có hệ phương trình: \(\left\{ \begin{array}{l}2a + 3b = 11\\3a + 4b = 15\end{array} \right.\)
Giải hệ phương trình, ta được: \(\left\{ \begin{array}{l}a = 1\\b = 3\end{array} \right.\)
Vì là chất khí nên %V = %n.
Vậy: \(\% {V_{{C_2}{H_6}}} = \% {n_{{C_2}{H_6}}}\)\(\, = \dfrac{1}{{1 + 3}} \times 100\% = 25\% \)
\(\% {V_{{C_3}{H_8}}} = \% {n_{{C_3}{H_8}}} \)\(\,= 100\% - 25\% = 75\% .\)
b)Tính hiệu suất phản ứng:
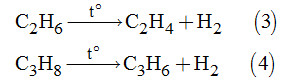
Giả sử ban đầu có 1 mol C2H6; 3 mol C3H8 và h là hiệu suất phản ứng:
Sau phản ứng (3) và (4) số mol của các chất là:
\(\begin{array}{l} + ){n_{{C_2}{H_4}}} = {n_{{H_2}}} = h\left( {mol} \right)\\ \Rightarrow {n_{{C_2}{H_6}}} = \left( {1 - h} \right)\left( {mol} \right)\\ + ){n_{{C_3}{H_6}}} = {n_{{H_2}}} = 3h\left( {mol} \right)\\ \Rightarrow {n_{{C_3}{H_6}}} = 3\left( {1 - h} \right)\left( {mol} \right)\end{array}\)
Ta có: \({d_{sp/{H_2}}} = \dfrac{{{{\overline M }_{sp}}}}{2} = 13,5 \Rightarrow {\overline M _{sp}} = 27\)
\( \Leftrightarrow \dfrac{{28 \times h + 2 \times 4h + 30 \times \left( {1 - h} \right) + 42 \times 3h + 44 \times 3\left( {1 - h} \right)}}{{4h + 4}} = 27\)
(với 2, 28, 30, 42, 44 là phân tử khối của H2, C2H4, C2H6, C3H6, C3H8)
\(\begin{array}{l} \Leftrightarrow 28h + 8h + 30 - 30h + 126h + 132 - 132h = 108h + 108\\ \Leftrightarrow 54 = 108h \Rightarrow h = 0,5\end{array}\)
Vậy hiệu suất phản ứng là: 50%.
Câu 14.
Gọi công thức tương đương của các ankin là: \({C_{\overline n }}{H_{2\overline n - 2}}\)
Và \(\alpha \) là số mol của ankin trong mỗi phần.
+ Phần 1.
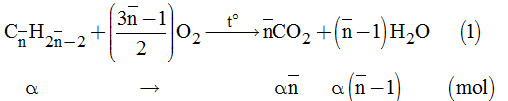
Theo đề bài, ta có hệ phương trình:
\(\left\{ \begin{array}{l}{n_{C{O_2}}} = \alpha \overline n = \dfrac{{0,896}}{{22,4}} = 0,4\\{n_{{H_2}O}} = \alpha \left( {\overline n - 1} \right) = \dfrac{{0,54}}{{18}} = 0,03\end{array} \right. \)
\(\Rightarrow \left\{ \begin{array}{l}\alpha = 0,01\\\overline n = 4\end{array} \right.\)
+ Phần 2.
\(\begin{array}{l}{C_{\overline n }}{H_{2\overline n - 2}} + 2B{r_2} \to {C_{\overline n }}{H_{2\overline n - 2}}B{r_4}{\rm{ }}\left( 2 \right)\\{\rm{ }}\alpha {\rm{ \;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\; 2}}\alpha {\rm{ }}\left( {mol} \right)\end{array}\)
Từ (2) \( \Rightarrow {n_{B{r_2}}}\)phản ứng \(2\alpha = 2 \times 0,01 = 0,02\left( {mol} \right)\)
\( \Rightarrow {m_{B{r_2}}}\)phản ứng \( = 0,02 \times 160 = 3,2\left( {gam} \right).\)
Câu 15:
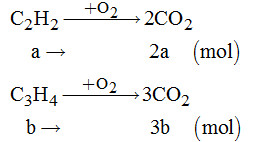
Theo đề bài ra, ta có hệ phương trình:
\(\left\{ \begin{array}{l}26a + 40b = 11,9\\2a + 3b = \dfrac{{20,16}}{{22,4}} = 0,9\end{array} \right. \)
\(\Rightarrow \left\{ \begin{array}{l}a = 0,15\\b = 0,2\end{array} \right.\)
Vậy: \(\% {m_{{C_2}{H_2}}} = \dfrac{{0,15 \times 26}}{{11,9}} \times 100\% \)\(\,= 32,77\% ;\)
\({\rm{ \% }}{{\rm{m}}_{{C_3}{H_4}}} = 67,23\% .\)
Câu 16.
Từ \({\left( {{C_2}{H_3}O} \right)_n} \Leftrightarrow {C_{2n}}{H_{3n}}{O_n} \)\(\,\Leftrightarrow {C_n}{H_{2n}}\left( {CHO} \right)n\)
Vì anđehit no nên;
Số nguyên tử H = 2\( \times \) số nguyên tử C + 2 – số nhóm chức
\( \Leftrightarrow 2n = 2 \times n + 2 - n \Rightarrow n = 2\)
Vậy công thức phân tử của anđehit là: C2H4(CHO)2 hay C4H6O2.
Search google: "từ khóa + timdapan.com" Ví dụ: "Đề số 1 - Đề kiểm tra học kì 2 - Hóa học 11 timdapan.com"







