Đề số 2 - Đề kiểm tra học kì 2 - Hóa học 11
Đáp án và lời giải chi tiết Đề số 2 - Đề kiểm tra học kì 2 (Đề thi học kì 2) - Hóa học 11
Đề bài
I. PHẦN TRẮC NGHIỆM
Câu 1. Đốt cháy hoàn toàn hỗn hợp hai hiđrocacbon có số mol bằng nhau và phân tử khối kém nhau 14 u thu được m gam nước và 2m gam CO2. Công thức phân tử của hai hiđrocacbon là:
A. C2H2 và C3H4. B. C4H10 và C5H12.
C. C3H6 và C4H8. D. CH4 và C2H6.
Câu 2. Phản ứng dùng để điều chế CH4 trong phòng thí nghiêm là:

Câu 3. Đốt cháy hoàn toàn một ankin (Z) ở thể khí, thu được CO2 và H2O có tổng khối lượng là 25,2 gam. Dẫn hết sản phẩm cháy qua dung dịch Ca(OH)2 dư thu được 45 gam kết tủa. Công thức phân tử của (Z) là:
A. C2H2. B. C4H8.
C. C3H4. D. C5H8.
Câu 4. Khi hiđro hóa hoàn toàn một ankin có xúc tác niken thu được sản phẩm là:
A.một anken mới có nhiều nguyên tử hiđro hơn.
B.một ankan có cùng số cacbon với ankin trên.
C.Một anken có nối đôi thay đổi.
D.một ankan có số nguyên tử cacbon lớn hơn số cacbon trong ankin ban đầu.
Câu 5. Polime \({\left[ \begin{array}{l}{H_2}C - CH - CH - C{H_2}\\{\rm{ | |}}\\{\rm{ C}}{{\rm{H}}_3}{\rm{ }}{{\rm{C}}_6}{H_5}\end{array} \right]_n}\) là sản phẩm trùng hợp từ những monome nào sau đây?
A. 2-metyl-3-phenylbutan.
B. Propilen và stiren.
C. Isopren và toluen.
D. Etilen và stiren.
Câu 6. Một hiđrocacbon (X) có phân tử khối được xác định trong khoảng 150 < MX < 170. Đốt cháy hoàn toàn m gam (X) sinh ra m gam H2O. Công thức phân tử của (X) là chất nào sau đây?
A. C8H10.
B. C9H12.
C. C10H14.
D. C12H18.
Câu 7. Biết khi cho ancol đơn chức (X) tác dụng với Br2 được dẫn xuất (Z) chứa 58,4% brom theo khối lượng và khi đun nóng với H2SO4 đặc ở \(170^\circ C\) thu được ba anken. Tên gọi của (X) là:
A. Butan-1-ol.
B. Butan-2-ol.
C. Propan-1-ol
D. 2-Metylpentan-2-ol.
Câu 3. Dãy nào sau đây được sắp xếp theo chiều tăng dần tính của axit?
\(\begin{array}{l}A.C{H_3}OH;{\rm{ }}C{H_3}C{H_2}OH;{\rm{ }}{H_2}O;{\rm{ }}{C_6}{H_5}OH.\\B.C{H_3}C{H_2}OH;{\rm{ }}{{\rm{H}}_2}O;{\rm{ C}}{{\rm{H}}_3}OH;{\rm{ }}{{\rm{C}}_6}{H_5}OH.\\C.C{H_3}C{H_2}OH;{\rm{ C}}{{\rm{H}}_3}OH;{\rm{ }}{{\rm{H}}_2}O;{\rm{ }}{{\rm{C}}_6}{H_5}OH.\\D.{H_2}O;{\rm{ C}}{{\rm{H}}_3}C{H_2}OH;{\rm{ C}}{{\rm{H}}_3}OH;{\rm{ }}{{\rm{C}}_6}{H_5}OH.\end{array}\)
Câu 9. Đốt cháy hết 0,05 mol ancol no (Z) mạch hở cần 3,92 lít O2 (đktc) thu được 6,6 gam CO2. Vậy (Z) có công thức phân tử:
A. C2H4(OH)2. B. C2H5OH.
C. C3H5(OH)3. D. C3H7OH.
Câu 10. Anđehit có thể tham gia phản ứng tráng bạc và phản ứng với H2 \(\left( {Ni,t^\circ } \right)\). Qua hai phản ứng này chứng tỏ anđehit có tính chất nào sau đây?
A. Chỉ thể hiện tính oxi hóa.
B. Chỉ thể hiện tính khử và tính oxi hóa.
C. Không thể hiện tính khử và tính oxi hóa.
D. Chỉ thể hiện tính khử.
Câu 11. Cho 7,4 gam hỗn hợp (Z) gồm hai axit hữu cơ no đơn chức tác dụng vừa đủ với Na2CO3 sinh ra 1,12 lít CO2 (đktc). Khối lượng muối thu được là:
A. 9,6 gam. B. 8 gam.
C. 7 gam. D. 10 gam.
Câu 12. Có hai ống nghiệm chứa hai dung dịch trong suốt như sau: ancol etylic \(45^\circ \) và dung dịch fomalin. Để phân biệt có thể dùng hóa chất nào sau đây?
A. Kali.
B. Dung dịch AgNO3/NH3.
C. Dung dịch NaOH.
D. Dung dịch Na2CO3.
II. PHẦN TỰ LUẬN
Câu 13. Khí cacbonic sinh ra khi đốt cháy 33,6 lít hỗn hợp propan và butan được dẫn vào dung dịch NaOH, tạo ra 286,2 gam Na2CO3 và 252 gam NaHCO3. Hãy xác định thành phần theo thể tích của hỗn hợp hai hiđrocacbon trên. Các thể tích khí được đo ở đktc.
Câu 14. Cho 11 gam hỗn hợp gồm 6,72 lít hiđrocacbon mạch hở A và 2,24 lít một ankin. Đốt cháy hỗn hợp này thì tiêu thụ 25,76 lít oxi. Các thể tích đo ở điều kiện tiêu chuẩn.
a)Xác định loại hiđrocacbon.
b)Cho 5,5 gam hỗn hợp trên cùng 1,5 gam hiđro vào một bình kín chứa sẵn một ít bột Ni. Đun nóng bình để phản ứng xảy ra hoàn toàn rồi đưa về \(0^\circ C\). Tính thành phần phần trăm thể tích mỗi khí và áp suất khí trong bình sau phản ứng. Biết áp suất trong bình trước phản ứng là 1atm.
Câu 15. Khi cho một ancol tác dụng với kim loại mạch dư. Nếu \({V_{{H_2}}}\) sinh ra bằng \(\dfrac{1}{2}\) Vhơi ancol đo ở cùng điều kiện thì đó là ancol mấy chức?
Câu 16. Thể tích hơi của 1,4 gam một anđehit Y bằng thể tích của 0,64 gam khí oxi ở cùng điều kiện về nhiệt độ và áp suất. Xác định công thức phân tử của anđehit Y đem dùng.
Lời giải chi tiết
I. PHẦN TRẮC NGHIỆM
|
Câu |
1 |
2 |
3 |
4 |
|
Đáp án |
B |
B |
C |
B |
|
Câu |
5 |
6 |
7 |
8 |
|
Đáp án |
B |
D |
B |
C |
|
Câu |
9 |
10 |
11 |
12 |
|
Đáp án |
C |
B |
A |
B |
II. PHẦN TỰ LUẬN
Câu 13.
Gọi công thức phân tử tương đương của C3H8 và C4H10 là: \({C_{\overline n }}{H_{2\overline n + 2}}\left( {3 < \overline n < 4} \right).\)
Ta có: \({C_{\overline n }}{H_{2\overline n + 2}} = \dfrac{{33,6}}{{22,4}} = 1,5\left( {mol} \right)\)
Và \({n_{N{a_2}C{O_3}}} = \dfrac{{286,2}}{{100}} = 2,7\left( {mol} \right);\) \({n_{NaHC{O_3}}} = \dfrac{{252}}{{84}} = 3\left( {mol} \right)\)
Phản ứng:
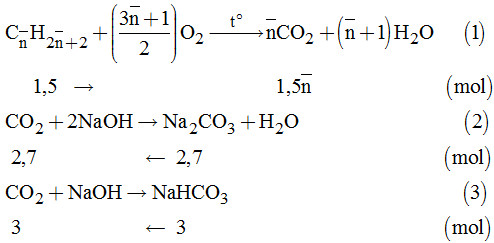
Từ (1), (2) và (3) \( \Rightarrow \sum {{n_{C{O_2}}}} = 1,5\overline n = 2,7 + 3\)
\(\Rightarrow \overline n = 3,8\)
Gọi x là thành phần phần trăm theo số mol khí C3H8 thì (1,5 – x) là thành phần theo số mol khí C4H10.
Ta có: \(\dfrac{{3x + \left( {1,5 - x} \right).4}}{{1,5}} = 3,8 \)
\(\Rightarrow 3x + \left( {1,5 - x} \right).4 = 5,7\)
\(\Rightarrow x = 0,3\left( {mol} \right)\)
Vì là chất khí nên %V = %n.
Vậy: \(\% {V_{{C_3}{H_8}}} = \% {n_{{C_3}{H_8}}} = \dfrac{{0,3}}{{1,5}} \times 100\% \)\(\, = 20\% \)
\(\% {V_{{C_4}{H_{10}}}} = \% {n_{{C_4}{H_{10}}}} = 100\% - 20\% \)\(\,= 80\% .\)
Câu 14.
a) Xác định loại hiđrocacbon
Ta có: \({n_A} = \dfrac{{6,72}}{{22,4}} = 0,3\left( {mol} \right)\)
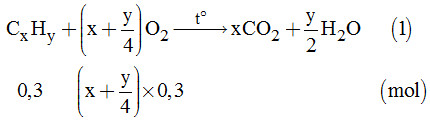
Gọi công thức tổng quát của ankin: CnH2n-2
Số mol của ankin là: \(\dfrac{{2,24}}{{22,4}} = 0,1\left( {mol} \right)\)
Số mol của oxi là: \(\dfrac{{25,76}}{{22,4}} = 1,15\left( {mol} \right)\)
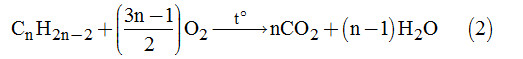
Từ phản ứng (1) và (2), ta có hệ phương trình:
\(\left\{ \begin{array}{l}\left( {12x + y} \right).0,3 + \left( {14n - 2} \right).0,1 = 11\\\left( {x + \dfrac{y}{4}} \right).0,3 + \left( {\dfrac{{3n - 1}}{2}} \right).0,1 = 1,15\end{array} \right. \)
\(\Leftrightarrow \left\{ \begin{array}{l}36x + 3y + 14n = 112\\4x + y + 2n = 16\end{array} \right.\)
Giải hệ phương trình trên, ta được:
\(y = 2x \Rightarrow 4x + 2x + 2n = 16 \)
\(\Leftrightarrow n = 8 - 3x > 0\)
\( \Rightarrow x < \dfrac{8}{3} = 2,66\) (x là số nguyên dương) \( \Rightarrow \) Nghiệm duy nhất x = 2.
Thay x = 2 vào phương trinh \(n = 8 - 3x \Rightarrow n = 2\)
Vậy công thức phân tử của ankin: C2H4 và của B: C2H2.
b)Tính thành phần phần trăm thể tích hỗn hợp và áp suất trung bình:
Số mol của C2H4 là: \(\dfrac{{0,3}}{2} = 0,15\left( {mol} \right)\).
Số mol của C2H2 là: \(\dfrac{{0,1}}{2} = 0,05\left( {mol} \right)\).
Và số mol hiđro là: \(\dfrac{{1,5}}{2} = 0,75\left( {mol} \right)\)
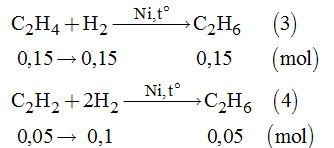
Từ (3), (4) \( \Rightarrow {n_{{C_2}{H_6}}} = 0,15 + 0,05 = 0,2\left( {mol} \right)\)
Và \({n_{{H_2}}}\)dư = 0,75 – 0,25 = 0,5 (mol)
Do đó sau phản ứng gồm các khí C2H6 và H2
Vậy: \(\% {V_{{C_2}{H_6}}} = \dfrac{{0,2}}{{0,5 + 0,2}} \times 100\% = 28,6\% \)
Và \(\% {V_{{H_2}}} = 100\% - 28,6\% = 71,4\% \)
+ Tính áp suất:
Áp dụng công thức: \(\dfrac{{{P_1}}}{{{P_2}}} = \dfrac{{{n_1}}}{{{n_2}}}\left( {{n_1} = 0,95;{n_2} = 0,7;{P_1} = 1atm} \right)\)
\( \Rightarrow {P_2} = \dfrac{{{P_1}.{n_2}}}{{{n_1}}} = \dfrac{{1 \times 0,7}}{{0,95}} \approx 0,74\left( {atm} \right).\)
Câu 15. Phản ứng:
\(\begin{array}{l}R{\left( {OH} \right)_n} + nNa \to R{\left( {ONa} \right)_n} + \dfrac{n}{2}{H_2} \uparrow \\{\rm{ \;\;1 \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\, }}\dfrac{n}{2}{\rm{ }}\left( {mol} \right)\\{\rm{ \;\;V \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\, }}\dfrac{V}{2}\end{array}\)
\( \Rightarrow n = 1.\) Vậy ancol đơn chức.
Câu 16.
Áp dụng định luật Avogađro, ta có:
\({V_X} = {V_{{O_2}}} \Rightarrow {n_X} = {n_{{O_2}}} = 0,02\left( {mol} \right)\)
\( \Rightarrow {M_X} = \dfrac{{1,4}}{{0,02}} = 70.\)
Gọi CTPT của Y có dạng: CxHy(CHO)n.
Mà \({M_X} = 12x + y + 29n = 70\left( {n \ge 1} \right)\)
Suy ra nghiệm phù hợp: n = 1; x = 3; y = 5.
Vậy công thức phân tử của Y: C3H5CHO.
Search google: "từ khóa + timdapan.com" Ví dụ: "Đề số 2 - Đề kiểm tra học kì 2 - Hóa học 11 timdapan.com"







