Đề số 3 - Đề kiểm tra học kì 2 - Hóa học 11
Đáp án và lời giải chi tiết Đề số 3 - Đề kiểm tra học kì 2 (Đề thi học kì 2) - Hóa học 11
Đề bài
I. PHẦN TRẮC NGHIỆM
Câu 1. Phản ứng giữa CH4 và Cl2 xảy ra khi được chiếu ánh sáng. Cơ chế của phản ứng trên thuộc loại nào sau đây?
A. Cơ chế gốc – dây chuyền.
B. Cơ chế cộng electrophin.
C. Cơ chế ion.
D. Cơ chế nucleophin.
Câu 2. Đốt cháy hết 30ml hỗn hợp 30ml metan và hiđro cần 45ml oxi (thể tích các khí đo ở cùng điều kiện). Thể tích mỗi khí trong hỗn hợp ban đầu lần lượt là:
A. 16ml và 14ml.
B. 20ml và 10ml.
C. 15ml và 15ml.
D. 13ml và 17ml.
Câu 3. Một hợp chất (X) mạch hở, có công thức phân tử là C4H8. Công thức cấu tạo của (X) là:
A.\(C{H_3} - CH = CH - C{H_3}.\)
B.\(C{H_2} = C{\left( {C{H_3}} \right)_2}.\)
C.\(C{H_2} = CH - C{H_2} - C{H_3}.\)
D.Cả A, B và C đều đúng.
Câu 4. Khi điều chế C2H4 từ C2H5OH có H2SO4 đặc làm xúc tác ở \(170^\circ C\) thường bị lẫn SO2. Cần phải dùng dung dịch nào sau đây để loại bỏ SO2?
A. KCl. B. K2CO3.
C. KOH. D. brom.
Câu 5. Nếu dùng dung dịch nước brom làm thuốc thử thì có thể phân biệt được cặp chất nào sau đây?
A. Etan và propan.
B. Buten và penten.
C. Etilen và stiren.
D. Toluen và stiren.
Câu 6. Cho 5,2 gam stiren đã bị trùng hợp một phần tác dụng với 100ml dung dịch brom 0,15M. Sau phản ứng cho thêm KI dư vào hỗn hợp thì thu được 0,635 gam iot. Phần trăm khối lượng của stiren đã trùng hợp là:
A. 75%. B. 80%.
C. 85%. D. 90%.
Câu 7. Khi đun nóng hỗn hợp ancol etylic và butan-2-ol ở \(170^\circ C\) và H2SO4 đặc làm xúc tác thì thu được tối đa bao nhiêu anken (kể cả đồng phân cis-trans)?
A.2. B.3.
C.4. D.5.
Câu 8. Đốt chay hoàn toàn 3,76 gam hỗn hợp gồm nhiều ancol no đơn chức mạch hở cần dùng 0,1 mol O2. Công thức phân tử của ancol có phân tử khối bé nhất là:
A. C4H9OH. B. C3H7OH.
C. C2H5OH. D. CH3OH.
Câu 9. Đốt cháy một ancol đa chức (Z) thu được CO2 và H2O có tỉ lệ mol tương ứng là 2 : 3. Công thức phân tử của (Z) là:
A. C2H6O2. B. C3H8O2.
C. C4H10O2. D. C5H12O2.
Câu 10. Anđehit no, đơn chức có thể biểu diễn bằng công thức tổng quát nào sau đây?
A. CnH2n-1O. B. CnH2n+1CHO.
C. Cn-1H2nO. D. CnH2n-1CHO.
Câu 11. Cho 1,69 gam hỗn hợp X gồm HCOOH, CH3COOH và C6H5OH tác dụng vừa đủ với Na thấy thoát ra 0,336 lít khí H2 (đktc). Khối lượng hỗn hợp chất rắn sau phản ứng là:
A. 2,75 gam. B. 2 gam.
C. 2,35 gam. D. 4 gam.
Câu 12. Cho công thức nguyên của anđehit no, mạch hở (X) là (C2H3O)n. Công thức phân tử (X) là:
A. C2H3O. B. C5H10O2.
C. C4H6O2. D. C6H10O4.
II. PHẦN TỰ LUẬN
Câu 13. Nếu cho 1,12 lít propen (đktc) phản ứng với dung dịch brom thì lượng brom tham gia phản ứng tối đa là bao nhiêu?
Câu 14. Hỗn hợp X gồm propin và ankin A có tỉ lệ 1 : 1 về số mol. Biết 0,224 lít hỗn hợp X (đktc) tác dụng vừa đủ với 15ml dung dịch AgNO3 1M trong NH3. Xác định công thức phân tử của A.
Câu 15. Cho 11 gam hỗn hợp 2 ancol no, đơn chức, kế tiếp nhau trong dãy đồng đẳng tác dụng hết với natri thu được 3,36 lít khí H2 (đktc). Mặt khác, đốt cháy hoàn toàn 11 gam hỗn hợp hai ancol trên tạo ra V lít CO2 (đktc) và m gam H2O.
a) Tính V và m.
b) Tìm công thức phân tử của 2 ancol và tính thành phần phần trăm theo khối lượng của hỗn hợp.
Câu 16. Lấy p gam hỗn hợp gồm CH3COOH và C2H5COOH tiến hành hai thí nghiệm sau:
Thí nghiệm 1: Cho p gam hỗn hợp tác dụng với natri dư thu được 336ml khí H2 (đktc).
Thí nghiệm 2. Trung hòa hết p gam hỗn hợp thì cần vừa đủ V ml dung dịch NaOH 0,1M. Cô cạn dung dịch sau phản ứng thu được 2,6 gam muối khan. Hãy tính phần trăm khối lượng mỗi axit trong hỗn hợp và giá trị V.
Lời giải chi tiết
I. PHẦN TRẮC NGHIỆM
|
Câu |
1 |
2 |
3 |
4 |
|
Đáp án |
A |
B |
D |
C |
|
Câu |
5 |
6 |
7 |
8 |
|
Đáp án |
D |
A |
C |
D |
|
Câu |
9 |
10 |
11 |
12 |
|
Đáp án |
A |
B |
C |
C |
II. PHẦN TỰ LUẬN
Câu 13.
Ta có: \({n_{{C_3}{H_6}}} = \dfrac{{1,12}}{{22,4}} = 0,05\left( {mol} \right)\)
Phản ứng: \(\begin{array}{l}{C_3}{H_6} + B{r_2} \to {C_3}{H_6}B{r_2}{\rm{ }}\left( 1 \right)\\{\rm{ 0,05}} \to {\rm{0,05}}\end{array}\)
Từ (1) \( \Rightarrow {n_{B{r_2}}}\)cần dùng = 0,05 (mol).
\({m_{B{r_2}}}\)cần dùng \( = 0,05 \times 160 = 8\left( {gam} \right).\)
Câu 14.
Ta có:\({n_A} = \dfrac{{0,224}}{{2 \times 22,4}} = 0,005\left( {mol} \right);\)\(\;{n_{AgN{O_3}}} = \dfrac{{15}}{{1000}} \times 1 = 0,015\left( {mol} \right)\)
Phản ứng xảy ra:
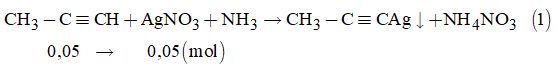
Từ (1) \( \Rightarrow {n_{AgN{O_3}}}\)đã phản ứng = 0,005 (mol)
\( \Rightarrow {n_{AgN{O_3}}}\)dư = 0,015 – 0,005 = 0,01 (mol).
Mà tỉ lệ: \({n_A}:{n_{AgN{O_3}}}\)dư = 0,005 : 0,01 = 1: 2
Vậy ankin A phải là axetilen C2H2 hay \(CH \equiv CH.\)
Phản ứng: \(CH \equiv CH + 2AgN{O_3} + 2N{H_3} \to \)\(\,AgC \equiv CAg \downarrow + 2N{H_4}N{O_3}\)
Câu 15. Gọi công thức chung của hai ancol là: \({C_{\overline n }}{H_{2\overline n + 1}}OH\)
Phản ứng:

Ta có: \({n_{{H_2}}} = \dfrac{{3,36}}{{22,4}} = 0,15\left( {mol} \right)\)
Từ (1) \( \Rightarrow {n_{{C_{\overline n }}{H_{2\overline n + 1}}OH}} = 0,3\left( {mol} \right)\)
\( \Rightarrow {\overline M _{{C_{\overline n }}{H_{2\overline n + 1}}OH}} = \dfrac{{11}}{{0,3}}\)
\( \Leftrightarrow 14\overline n + 18 = \dfrac{{11}}{{0,3}}\)
\(\Rightarrow \overline n = \dfrac{4}{3} = 1,3333\)
a) Tính V và m:
+ Tính V:
Từ (2) \( \Rightarrow {n_{C{O_2}}} = 0,3\overline n = 0,3 \times \dfrac{4}{3} = 0,4\left( {mol} \right)\)
\( \Rightarrow {V_{C{O_2}}} = 0,4 \times 22,4 = 8,96\) (lít).
+ Tính m:
Từ (2) \( \Rightarrow {n_{{H_2}O}} = \left( {\overline n + 1} \right).0,3 \)\(\,= \left( {\dfrac{4}{3} + 1} \right).0,3 = 0,7\left( {mol} \right)\)
\( \Rightarrow m = {m_{{H_2}O}} = 0,7 \times 18 = 12,6\left( {g} \right).\)
b) Xác định công thức phân tử 2 ancol và phần trăm của mỗi ancol:
Vì 2 ancol đồng đẳng kế tiếp nhau nên:
\(n < \overline n < m\) (với n, m là số C trong hai ancol, giả sử n < m)
\( \Leftrightarrow n < \overline n = 1,333 < m = n = 1\)
\(\Rightarrow 0,333 < n < 1,333\)
Vậy duy nhất \(n = 1 \Rightarrow \) Ancol thứ nhất là CH3OH và ancol thức hai là C2H5OH.
+ Tính phần trăm mỗi ancol:
Gọi x là số mol của \({C_2}{H_5}OH \Rightarrow \left( {0,3 - x} \right)\) là số mol của CH3OH ta có phương trình: \(46x + 32\left( {0,3 - x} \right) = 11 \Rightarrow x = 0,1\)
Vậy
Câu 16. Ta có: \(\% {m_{{C_2}{H_5}OH}} = \dfrac{{0,1 \times 46}}{{11}} \times 100\% \)\(\,= 41,82\% \)
Gọi a là số mol của CH3COOH và b là số mol của C2H5COOH trong p gam hỗn hợp.
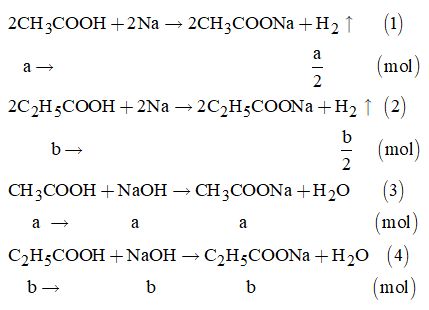
Theo đề bài, ta có hệ phương trình: \(\left\{ \begin{array}{l}\dfrac{1}{2}a + \dfrac{1}{2}b = 0,015\\82a + 96b = 2,6\end{array} \right. \Rightarrow \left\{ \begin{array}{l}a = 0,02\\b = 0,01\end{array} \right.\)
\( \Rightarrow {m_{C{H_3}COOH}} = 0,02 \times 60 = 1,2\left( {gam} \right)\)
Và \({m_{{C_2}{H_5}COOH}} = 0,01 \times 74 = 0,74\left( {gam} \right)\)
Vậy: \(\% {m_{C{H_3}COOH}} = \dfrac{{1,2}}{{1,94}} \times 100\% \)\(\, = 61,86\% \)
\(\% {m_{{C_2}{H_5}COOH}} = 100\% - 61,86\%\)\(\, = 38,14\% \)
Từ (3) và (4) \( \Rightarrow \sum {{n_{NaOH}}} = a + b = 0,02 + 0,01 \)\(\,= 0,03\left( {mol} \right)\)
\( \Rightarrow {V_{NaOH}} = \dfrac{n}{{{C_{M/NaOH}}}} = \dfrac{{0,03}}{{0,1}} = 0,3\) (lít).
Search google: "từ khóa + timdapan.com" Ví dụ: "Đề số 3 - Đề kiểm tra học kì 2 - Hóa học 11 timdapan.com"







