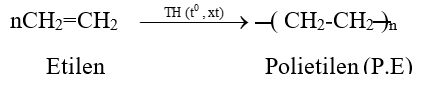Đề cương ôn tập học kỳ II môn Hóa lớp 11
Tổng hợp kiến thức cần nắm vững, các dạng bài tập và câu hỏi có khả năng xuất hiện trong đề thi HK2 Hóa học 11 sắp tới
A. ĐẠI CƯƠNG HÓA HỮU CƠ
I. MỞ ĐẦU VỀ HÓA HỌC HỮU CƠ
1. Khái niệm về hợp chất hữu cơ và hóa học hữu cơ
- Hợp chất hữu cơ là hợp chất của cacbon (trừ CO, CO2, muối cacbonat…).
- Hóa học hữu cơ là nghành hóa học nghiên cứu các hợp chất hữu cơ.
2. Phân loại hợp chất hữu cơ
- Thường chia thành hai loại
+ Hiđrocacbon
+ Dẫn xuất hiđrocacbon
3. Đặc điểm chung của hợp chất hữu cơ
- Đặc điểm cấu tạo: Liên kết hóa học chủ yếu trong hợp chất hữu cơ là liên kết cộng hóa trị.
- Tính chất vật lý:
+ Nhiệt độ nóng chảy, nhiệt độ sôi thấp.
+ Phần lớn không tan trong nước, nhưng tan nhiều trong các dung môi hữu cơ.
- Tính chất hóa học:
+ Các hợp chất hữu cơ thường kém bền với nhiệt và dễ cháy.
+ Phản ứng hóa học của các hợp chất hữu cơ thường xảy ra chậm và theo nhiều hướng khác nhau, nên tạo ra hỗn hợp nhiều sản phẩm.
4. Sơ lược về phân tích nguyên tố
a. Phân tích định tính
* Mục đích: Xác định nguyên tố nào có trong hợp chất hữu cơ.
* Nguyên tắc: Chuyển các nguyên tố trong hợp chất hữu cơ thành các chất vô cơ đơn giản rồi nhận biết chúng bằng các phản ứng đặc trưng.
b. Phân tích định lượng
* Mục đích: Xác định thành phần % về khối lượng các nguyên tố có trong phân tử hợp chất hữu cơ.
* Nguyên tắc: Cân chính xác khối lượng hợp chất hữu cơ, sau đó chuyển nguyên tố C → CO2, H → H2O, N → N2, sau đó xác định chính xác khối lượng hoặc thể tích của các chất tạo thành, từ đó tính % khối lượng các nguyên tố.
* Biểu thức tính toán:
\({{\mathrm{m}}_{\mathrm{C}}}\mathrm{=}\frac{{{\mathrm{m}}_{\mathrm{C}{{\mathrm{O}}_{\mathrm{2}}}}}\mathrm{.12}}{\mathrm{44}}\mathrm{(g)}\); \({{\mathrm{m}}_{\mathrm{H}}}\mathrm{=}\frac{{{\mathrm{m}}_{{{\mathrm{H}}_{\mathrm{2}}}\mathrm{O}}}\mathrm{.2}}{\mathrm{18}}\mathrm{(g)}\); \({{\mathrm{m}}_{\mathrm{N}}}\mathrm{=}\frac{{{\mathrm{V}}_{{{\mathrm{N}}_{\mathrm{2}}}}}\mathrm{.28}}{\mathrm{22,4}}\mathrm{(g)}\)
- Tính được:
%O = 100 - %C - %H - %N
II. CÔNG THỨC PHÂN TỬ HỢP CHẤT HỮU CƠ
1. Công thức đơn giản nhất
a. Định nghĩa
- Công thức đơn giản nhất là công thức biểu thị tỉ lệ tối giản về số nguyên tử của các nguyên tố trong phân tử.
b. Cách thiết lập công thức đơn giản nhất
- Thiết lập công thức đơn giản nhất của hợp chất hữu cơ CxHyOz là thiết lập tỉ lệ
2. Công thức phân tử
a. Định nghĩa
- Công thức phân tử là công thức biểu thị số lượng nguyên tử của mỗi nguyên tố trong phân tử.
b. Cách thiết lập công thức phân tử
- Có ba cách thiết lập công thức phân tử
* Dựa vào thành phần % khối lượng các nguyên tố
- Cho CTPT CxHyOz: ta có tỉ lệ
\(\frac{{\rm{M}}}{{{\rm{100}}}}{\rm{ = }}\frac{{{\rm{12}}.{\rm{x}}}}{{\% {\rm{ C}}}}{\rm{ = }}\frac{{{\rm{1}}.{\rm{y}}}}{{\% {\rm{ H}}}}{\rm{ = }}\frac{{{\rm{16}}.{\rm{z}}}}{{\% {\rm{ O}}}}\)
Từ đó ta có:
\(\mathrm{x=}\frac{\mathrm{M}\mathrm{. }\!\!%\!\!\text{ C}}{\mathrm{12}\mathrm{.100}}\); \(\mathrm{y=}\frac{\mathrm{M}\mathrm{. }\!\!%\!\!\text{ H}}{\mathrm{1}\mathrm{.100}}\); \(\mathrm{z=}\frac{\mathrm{M}\mathrm{. }\!\!%\!\!\text{ O}}{\mathrm{16}\mathrm{.100}}\)
* Dựa vào công thức đơn giản nhất
* Tính trực tiếp theo khối lượng sản phẩm cháy
B. HIDROCACBON
I. ANKAN
1. Khái niệm - Đồng đẵng - Đồng phân - Danh pháp
a. Khái niệm
- Ankan là hidrocacbon no mạch hở có CTTQ CnH2n+2 (n≥1). Hay còn gọi là parafin
- Các chất CH4, C2H6, C3H8 …. CnH2n+2 hợp thành dãy đồng đẳng của ankan.
b. Đồng phân
- Từ C4H10 trở đi có đồng phân cấu tạo (đồng phân mạch C).
- Thí dụ: C5H10 có ba đồng phân:
CH3-CH2-CH2-CH2CH3;
CH3-CH(CH3)-CH2-CH3;
CH3-C(CH3)2-CH3
c. Danh pháp
- Nắm tên các ankan mạch không nhánh từ C1 → C10
- Danh pháp thường.
- n - tên ankan tương ứng (n- ứng với mạch C không phân nhánh)
- iso - tên ankan tương ứng (iso- ở C thứ hai có nhánh -CH3).
- neo - tên ankan tương ứng (neo- ở C thứ hai có hai nhánh -CH3).
- Danh pháp quốc tế: Số chỉ vị trí nhánh + tên nhánh + tên mạch C chính + an
Thí dụ: \(\overset{\mathrm{1}}{\mathop{\mathrm{C}}}\,{{\mathrm{H}}_{\mathrm{3}}}\mathrm{-}\overset{\mathrm{2}}{\mathop{\mathrm{C}}}\,\mathrm{H(C}{{\mathrm{H}}_{\mathrm{3}}}\mathrm{)-}\overset{\mathrm{3}}{\mathop{\mathrm{C}}}\,{{\mathrm{H}}_{\mathrm{2}}}\mathrm{-}\overset{\mathrm{4}}{\mathop{\mathrm{C}}}\,{{\mathrm{H}}_{\mathrm{3}}}\)
(2-metylbutan)
- Bậc của nguyên tử C trong hiđrocacbon no được tính bằng số liên kết của nó với các nguyên tử C khác.
Thí dụ: \(\overset{\mathrm{I}}{\mathop{\mathrm{C}}}\,{{\mathrm{H}}_{\mathrm{3}}}\mathrm{-}\overset{\mathrm{IV}}{\mathop{\mathrm{C}}}\,{{\mathrm{(C}{{\mathrm{H}}_{\mathrm{3}}}\mathrm{)}}_{\mathrm{2}}}\mathrm{-}\overset{\mathrm{III}}{\mathop{\mathrm{C}}}\,\mathrm{H(C}{{\mathrm{H}}_{\mathrm{3}}}\mathrm{)-}\overset{\mathrm{II}}{\mathop{\mathrm{C}}}\,{{\mathrm{H}}_{\mathrm{2}}}\mathrm{-}\overset{\mathrm{I}}{\mathop{\mathrm{C}}}\,{{\mathrm{H}}_{\mathrm{3}}}\)
2. Tính chất vật lý
- Từ CH4 → C4H10 là chất khí.
- Từ C5H12 → C17H36 là chất lỏng.
- Từ C18H38 trở đi là chất rắn.
3. Tính chất hóa học
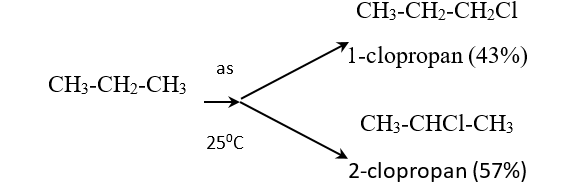
a. Phản ứng thế bởi halogen (đặc trưng cho hidrocacbon no)
- Clo có thể thế lần lượt từng nguyên tử H trong phân tử metan
CH4 + Cl2 \(\xrightarrow{\mathrm{askt}}\) CH3Cl + HCl
- Các đồng đẵng của metan cũng tham gia phản ứng thế tương tự metan
- Nhận xét: Nguyên tử H liên kết với nguyên tử C bậc cao hơn dể bị thế hơn nguyên tử H liên kết với nguyên tử C bậc thấp hơn.
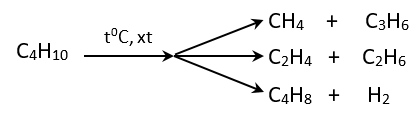
b. Phản ứng tách.
\({{\mathrm{C}}_{\mathrm{n}}}{{\mathrm{H}}_{\mathrm{2n+2}}}\xrightarrow{{{\mathrm{t}}^{\mathrm{0}}}\mathrm{, xt}}{{\mathrm{C}}_{\mathrm{n}}}{{\mathrm{H}}_{\mathrm{2n}}}\mathrm{+}{{\mathrm{H}}_{\mathrm{2}}}\)
\({{\mathrm{C}}_{\mathrm{n}}}{{\mathrm{H}}_{\mathrm{2n+2}}}\xrightarrow{{{\mathrm{t}}^{\mathrm{0}}}\mathrm{, xt}}{{\mathrm{C}}_{\mathrm{n }\!\!'\!\!\text{ }}}{{\mathrm{H}}_{\mathrm{2n }\!\!'\!\!\text{ }}}\mathrm{+}{{\mathrm{C}}_{\mathrm{m}}}{{\mathrm{H}}_{\mathrm{2m+2}}}\mathrm{(n=n }\!\!'\!\!\text{ +m)}\)
- Thí dụ
CH3-CH3 \(\xrightarrow{\mathrm{50}{{\mathrm{0}}^{\mathrm{0}}}\mathrm{C, xt}}\) CH2=CH2 + H2
c. Phản ứng oxi hóa.
CnH2n+2 + \(\frac{\mathrm{3n+1}}{\mathrm{2}}\)O2 → nCO2 + nH2O
4. Điều chế:
a. Phòng thí nghiệm:
- CH3COONa + NaOH \(\xrightarrow{\mathrm{CaO, }{{\mathrm{t}}^{\mathrm{0}}}}\) CH4↑+ Na2CO3
- Al4C3 + 12H2O → 3CH4↑ + 4Al(OH)3
b. Trong công nghiệp:
Đi từ khí thiên nhiên, khí mỏ dầu và từ dầu mỏ.
II. ANKEN
1. Khái niệm - Đồng phân - Danh pháp
a. Khái niệm:
- Anken là hidrocacbon không no mạch hở có một nối đôi trong phân tử. Có CTTQ là CnH2n (n)
- Các chất C2H4, C3H6, C4H8 . . . CnH2n (n≥2) hợp thành dãy đồng đẵng của anken.
b. Đồng phân: Có hai loại đồng phân
- Đồng phân cấu tạo: (Đồng phân mạch C và đồng phân vị trí liên kết đôi)
Thí dụ: C4H8 có ba đồng phân cấu tạo.
CH2=CH-CH2-CH3;CH3-CH=CH-CH3; CH2=C(CH3)-CH3
- Đồng phân hình học (cis - trans): Cho anken có CTCT: abC=Ccd.
Điều kiện để xuất hiện đồng phân hình học là: a ≠ b và c ≠ d.
c. Danh pháp:
- Danh pháp thường: Tên ankan nhưng thay đuôi an = ilen.
+ Ví dụ: C2H4 (Etilen), C3H6 (propilen)
- Danh pháp quốc tế (tên thay thế):
Số chỉ vị trí nhánh + tên nhánh + tên mạch C chính + số chỉ vị trí liên kết đôi + en
+ Ví dụ: \(\overset{\mathrm{4}}{\mathop{\mathrm{C}}}\,{{\mathrm{H}}_{\mathrm{3}}}\mathrm{-}\overset{\mathrm{3}}{\mathop{\mathrm{C}}}\,\mathrm{H=}\overset{\mathrm{2}}{\mathop{\mathrm{C}}}\,\mathrm{H-}\overset{\mathrm{1}}{\mathop{\mathrm{C}}}\,{{\mathrm{H}}_{\mathrm{3}}}\) (C4H8) But-2-en
\(\overset{\mathrm{1}}{\mathop{\mathrm{C}}}\,{{\mathrm{H}}_{\mathrm{2}}}\mathrm{=}\overset{\mathrm{2}}{\mathop{\mathrm{C}}}\,\mathrm{(C}{{\mathrm{H}}_{\mathrm{3}}}\mathrm{)-}\overset{\mathrm{3}}{\mathop{\mathrm{C}}}\,{{\mathrm{H}}_{\mathrm{3}}}\) (C4H8) 2 - Metylprop-1-en
2. Tính chất vật lý
Ở điều kiện thường thì
- Từ C2H4 → C4H8 là chất khí.
- Từ C5H10 trở đi là chất lỏng hoặc chất rắn.
3. Tính chất hóa học
a. Phản ứng cộng (đặc trưng)
* Cộng H2: CnH2n+H2 \(\xrightarrow{\mathrm{Ni, }{{\mathrm{t}}^{\mathrm{0}}}}\)CnH2n+2
CH2=CH-CH3+H2 \(\xrightarrow{\mathrm{Ni, }{{\mathrm{t}}^{\mathrm{0}}}}\)CH3-CH2-CH3
* Cộng Halogen: CnH2n + X2 → CnH2nX2
CH2=CH2 + Br2 → CH2Br-CH2Br
Phản ứng anken tác dụng với Br2 dùng để nhận biết anken (dd Br2 mất màu)
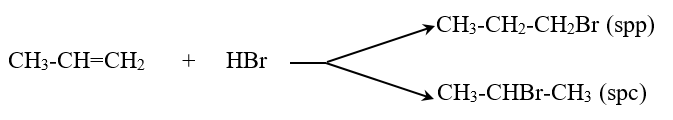
* Cộng HX (X: Cl, Br, OH . . .)
Thí dụ:
CH2=CH2 + HOH \(\xrightarrow{{{\mathrm{H}}^{\mathrm{+}}}}\) CH3-CH2OH
CH2=CH2 + HBr \(\xrightarrow{{}}\) CH3-CH2Br
- Các anken có cấu tạo phân tử không đối xứng khi cộng HX có thể cho hỗn hợp hai sản phẩm
- Quy tắc Maccopnhicop: Trong phản ứng cộng HX vào liên kết đôi, nguyên tử H (phần mang điện dương) chủ yếu cộng vào nguyên tử C bậc thấp hơn (có nhiều H hơn), còn nguyên hay nhóm nguyên tử X (phần mang điện âm) cộng vào nguyên tử C bậc cao hơn (ít H hơn).
b. Phản ứng trùng hợp:
Điều kiện: Phân tử phải có liên kết đôi C=C.
c. Phản ứng oxi hóa:
- Oxi hóa hoàn toàn:
CnH2n + \(\frac{\mathrm{3n}}{\mathrm{2}}\)O2\(\xrightarrow{{{\mathrm{t}}^{\mathrm{0}}}}\)nCO2 + nH2O
- Oxi hóa không hoàn toàn: Anken có thể làm mất màu dung dịch B2 và dung dịch thuốc tím. Phản ứng này dùng để nhận biết anken và hợp chất chứa liên kết \(\pi\).
4. Điều chế
a. Phòng thí nghiệm:
CnH2n+1OH \(\xrightarrow{{{\mathrm{H}}_{\mathrm{2}}}\mathrm{S}{{\mathrm{O}}_{\mathrm{4}}}\mathrm{, 17}{{\mathrm{0}}^{\mathrm{0}}}\mathrm{C}}\) CnH2n+H2O
b. Điều chế từ ankan:
CnH2n+2\(\xrightarrow{{{\mathrm{t}}^{\mathrm{0}}}\mathrm{, p, xt}}\)CnH2n + H2
III. ANKADIEN
1. Định nghĩa - Phân loại - Danh pháp
a. Định nghĩa: Là hidrocacbon không no mạch hở, trong phân tử chứa hai liên kết C=C, có CTTQ CnH2n-2 (n)
- Ví dụ: CH2=C=CH2, CH2=CH-CH=CH2 . . .
b. Phân loại:
Có ba loại:
- Ankadien có hai liên kết đôi liên tiếp.
- Ankadien có hai liên kết đôi cách nhau bởi một liên kết đơn (ankadien liên hợp).
- Ankadien có hai liên kết đôi cách nhau từ hai liên kết đơn trở lên.
c. Danh pháp:
Số chỉ vị trí nhánh + tên nhánh + tên anka mạch C chính + số chỉ vị trí liên kết đôi + đien.
CH2=CH-CH=CH2 (buta-1,3-đien)
2. Tính chất hóa học
a. Phản ứng cộng (H2, X2, HX)
* Cộng H2:
CH2=CH-CH=CH2 + 2H2 \(\xrightarrow{\mathrm{Ni, }{{\mathrm{t}}^{\mathrm{0}}}}\)CH3-CH2-CH2-CH3
* Cộng brom:
Cộng 1:2
CH2=CH-CH=CH2+ Br2 (dd) \(\xrightarrow{\mathrm{-8}{{\mathrm{0}}^{\mathrm{0}}}\mathrm{C}}\) CH2=CH-CHBr-CH2Br (spc)
Cộng 1:4
CH2=CH-CH=CH2 + Br2 (dd)\(\xrightarrow{\mathrm{4}{{\mathrm{0}}^{\mathrm{0}}}\mathrm{C}}\)CH2Br-CH=CH-CH2Br (spc)
Cộng đồng thời vào hai liên kết đôi
CH2=CH-CH=CH2 + 2Br2 (dd) \(\xrightarrow{{}}\) CH2Br-CHBr-CHBr-CH2Br
* Cộng HX
Cộng 1:2
CH2=CH-CH=CH2 + HBr \(\xrightarrow{\mathrm{-8}{{\mathrm{0}}^{\mathrm{0}}}\mathrm{C}}\)CH2=CH-CHBr-CH3 (spc)
Cộng 1:4
CH2=CH-CH=CH2+ HBr \(\xrightarrow{\mathrm{4}{{\mathrm{0}}^{\mathrm{0}}}\mathrm{C}}\) CH2=CH-CH2-CH2Br (spc)
b. Phản ứng trùng hợp:
VD:
(cao su buna)
c. Phản ứng oxi hóa:
- Oxi hóa hoàn toàn
2C4H6 + 11O2 \(\xrightarrow{{{\mathrm{t}}^{\mathrm{0}}}}\) 8CO2 + 6H2O
- Oxi hóa không hoàn toàn: Tương tự như anken thì ankadien có thể làm mất màu dung dịch thuốc tím. Phản ứng này dùng để nhận biết ankadien.
3. Điều chế
- Được điều chế từ ankan tương ứng bằng phản ứng tách H2.
CH3CH2CH2CH3\(\xrightarrow{\mathrm{xt, }{{\mathrm{t}}^{\mathrm{0}}}}\)CH2=CH-CH=CH2+2H2
CH3-CH(CH3)-CH2-CH3 \(\xrightarrow{\mathrm{xt, }{{\mathrm{t}}^{\mathrm{0}}}}\) CH2=C(CH3)-CH=CH2 +2H2
IV. ANKIN
1. Khái niệm - Đồng phân - Danh pháp
a. Khái niệm
- Là hidrocacbon không no mạch hở trong phân tử có một liên kết , có CTTQ là CnH2n-2 (n2).
- Các chất C2H2, C3H4, C4H6 . . .CnH2n-2 (n2) hợp thành một dãy đồng đẵng của axetilen.
b. Đồng phân
- Chỉ có đồng phân cấu tạo (đồng phân mạch C và đồng phân vị trí liên kết ). Ankin không có đồng phân hình học.
- Thí dụ: C4H6 có hai đồng phân
CH≡C-CH2-CH3; CH3-C≡C-CH3.
c. Danh pháp:
- Danh pháp thường: Tên gốc ankyl + axetilen
+ VD: C2H2 (axetilen), CH≡C-CH3 (metylaxetilen)
- Danh pháp thay thế:
Số chỉ vị trí nhánh + tên nhánh + tên mạch C chính + số chỉ vị trí nối 3 + in
\(\overset{\mathrm{4}}{\mathop{\mathrm{C}}}\,{{\mathrm{H}}_{\mathrm{3}}}\mathrm{-}\overset{\mathrm{3}}{\mathop{\mathrm{C}}}\,{{\mathrm{H}}_{\mathrm{2}}}\mathrm{-}\overset{\mathrm{2}}{\mathop{\mathrm{C}}}\,\equiv \overset{\mathrm{1}}{\mathop{\mathrm{C}}}\,\mathrm{H}\)
But-1-in
\(\overset{\mathrm{4}}{\mathop{\mathrm{C}}}\,{{\mathrm{H}}_{\mathrm{3}}}\mathrm{-}\overset{\mathrm{3}}{\mathop{\mathrm{C}}}\,\equiv \overset{\mathrm{2}}{\mathop{\mathrm{C}}}\,\mathrm{-}\overset{\mathrm{1}}{\mathop{\mathrm{C}}}\,{{\mathrm{H}}_{\mathrm{3}}}\)
But-2-in
2. Tính chất hóa học:
a. Phản ứng cộng (H2, X2, HX, phản ứng đime hóa và trime hóa).
- Thí dụ
+ Cộng H2
CH≡CH + H2 \(\xrightarrow{\mathrm{Ni, }{{\mathrm{t}}^{\mathrm{0}}}}\) CH2=CH2
CH2=CH2 + H2 \(\xrightarrow{\mathrm{Ni, }{{\mathrm{t}}^{\mathrm{0}}}}\) CH3-CH3
Nếu dùng xúc tác Pd/PbCO3 hoặc Pd/BaSO4, ankin chỉ cộng một phân tử H2 tạo anken
CH≡CH + H2 \(\xrightarrow{\mathrm{Pd/PbC}{{\mathrm{O}}_{\mathrm{3}}}\mathrm{, }{{\mathrm{t}}^{\mathrm{0}}}}\) CH2=CH2
+ Cộng X2
CH≡CH + Br2 \(\xrightarrow{{}}\) CHBr=CHBr
CHBr=CHBr + Br2 \(\xrightarrow{{}}\) CHBr2-CHBr2
+ Cộng HX
CH≡CH + HCl \(\xrightarrow[\mathrm{150-20}{{\mathrm{0}}^{\mathrm{0}}}\mathrm{C}]{\mathrm{HgC}{{\mathrm{l}}_{\mathrm{2}}}}\) CH2 =CHCl
+ Phản ứng đime hóa - trime hóa
2CH≡CH \(\xrightarrow{\mathrm{xt, }{{\mathrm{t}}^{\mathrm{0}}}}\) CH2=CH-C≡CH
(vinyl axetilen)
3CH≡CH \(\xrightarrow[\mathrm{xt}]{\mathrm{60}{{\mathrm{0}}^{\mathrm{0}}}\mathrm{C}}\) C6H6
b. Phản ứng thế bằng ion kim loại:
- Điều kiện: Phải có liên kết 3 ở đầu mạch.
R-C≡CH + AgNO3 + NH3 → R-C≡CAg↓+ NH4NO3
Phản ứng này dùng để nhận biết Ank-1-in
c. Phản ứng oxi hóa:
- Oxi hóa hoàn toàn:
CnH2n-2+ O2 → nCO2 + (n-1)H2O
- Oxi hóa không hoàn toàn: Tương tự như anken và ankadien, ankin cũng có khả năng làm mất màu dung dịch thuốc tím. Phản ứng này dùng để nhận biết ankin.
3. Điều chế:
a. Phòng thí nghiệm:
CaC2 + 2H2O → C2H2↑ + Ca(OH)2
b. Trong công nghiệp:
2CH4 \(\xrightarrow{\mathrm{150}{{\mathrm{0}}^{\mathrm{0}}}\mathrm{C}}\) C2H2 + 3H2
V. BENZEN VÀ DÃY ĐỒNG ĐẴNG:
1. Đồng đẳng - Đồng phân - Danh pháp:
a. Đồng đẳng: Dãy đồng đẵng của benzen có CTTQ là CnH2n-6.
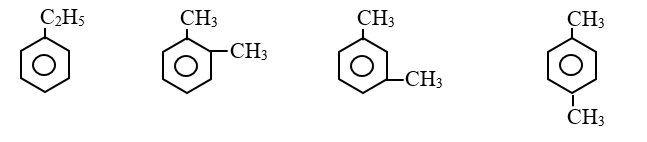
b. Đồng phân: Đồng phân về vị trí tương đối của các nhóm ankyl xung quanh vòng benzen (o, m, p).
- Ví dụ: C8H10
c. Danh pháp: Gọi tên theo danh pháp hệ thống.
Số chỉ vị trí nhóm ankyl + tên ankyl + benzen.
- VD: C6H5CH3 (metylbenzen).
2. Tính chât hóa học:
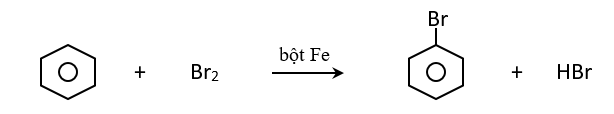
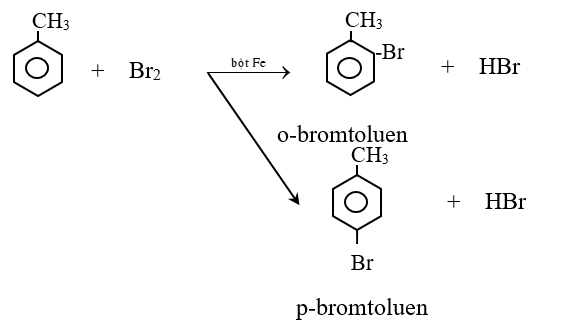
a. Phản ứng thế:
* Thế nguyên tử H ở vòng benzen
- Tác dụng với halogen
Cho ankyl benzen phản ứng với brom có bột sắt thì thu được hỗn hợp sản phẩm thế brom chủ yếu vào vị trí ortho và para.
- Phản ứng giữa benzen và đồng đẳng với axit HNO3 xãy ra tương tự như phản ứng với halogen.
- Quy tắc thế H ở vòng benzen: Các ankyl benzen dể tham gia phản ứng thế nguyên tử H của vòng benzen hơn benzen và sự thế ưu tiên ở vị trí ortho và para so với nhóm ankyl.
* Thế nguyên tử H ở mạch chính
- C6H5CH3 + Br2 \(\xrightarrow{{{t}^{0}}}\) C6H5CH2Br + HBr
b. Phản ứng cộng:
- Cộng H2 và cộng Cl2.
c. Phản ứng oxi hóa:
- Oxi hóa không hoàn toàn: Toluen có khả năng làm mất màu dung dịch thuốc tím còn benzen thì không. Phản ứng này dùng để nhận biết Toluen.
- Phản ứng oxi hóa hoàn toàn:
CnH2n-6 + \(\frac{\mathrm{3n-3}}{\mathrm{2}}\)O2 → nCO2 + (n-3)H2O
VI. STIREN:
1. Cấu tạo: CTPT: C8H8;
CTCT:
2. Tính chất hóa học:
a. Phản ứng với dung dịch Br2. Phản ứng này dùng để nhận biết stiren.
b. Phản ứng với H2.
c. Tham gia phản ứng trùng hợp ở liên kết đôi C=C.
VII. NAPTTALEN: CTPT: C10H8.
1. CTCT:
2. Tính chất hóa học:
- Tham gia phản ứng thế và tham gia phản ứng cộng.
B. ANCOL- PHENOL
I. ANCOL
1. Định nghĩa - Phân loại
a. Định nghĩa
- Ancol là những hợp chất hữu cơ trong phân tử có nhóm OH liên kết trực tiếp với nguyên tử C no. Ví dụ: C2H5OH
- Bậc ancol là bậc của nguyên tử C liên kết trực tiếp với nhóm OH.
Thí dụ
CH3-CH2-CH2-CH2OH: ancol bậc I
CH3-CH2-CH(CH3)-OH: ancol bậc II
CH3-C(CH3)2-OH: ancol bậc III
b. Phân loại
- Ancol no, đơn chức, mạch hở (CnH2n+1OH): Ví dụ: CH3OH . . .
- Ancol không no, đơn chức mạch hở: CH2=CH-CH2OH
- Ancol thơm đơn chức: C6H5CH2OH
- Ancol đa chức: CH2OH-CH2OH (etilen glicol),
CH2OH-CHOH-CH2OH (glixerol)
2. Đồng phân - Danh pháp
a. Đồng phân: Chỉ có đồng phân cấu tạo (gồm đồng phân mạch C và đồng phân vị trí nhóm OH).
- Thí dụ C4H10O có 4 đồng phân ancol
CH3-CH2-CH2-CH2OH;
CH3-CH(CH3)-CH2OH
CH3-CH2-CH(CH3)-OH;
CH3-C(CH3)2-OH
b. Danh pháp:
- Danh pháp thường: Ancol + tên gốc ankyl + ic
+ Ví dụ: C2H5OH (ancol etylic)
- Danh pháp thay thế: Tên hidrocacbon tương ứng với mạch chính + số chỉ vị trí nhóm OH + ol
+ Ví dụ:
\(\overset{\mathrm{4}}{\mathop{\mathrm{C}}}\,{{\mathrm{H}}_{\mathrm{3}}}\overset{\mathrm{3}}{\mathop{\mathrm{C}}}\,\mathrm{H(C}{{\mathrm{H}}_{\mathrm{3}}}\mathrm{)}\overset{\mathrm{2}}{\mathop{\mathrm{C}}}\,{{\mathrm{H}}_{\mathrm{2}}}\overset{\mathrm{1}}{\mathop{\mathrm{C}}}\,{{\mathrm{H}}_{\mathrm{2}}}\mathrm{OH}\)
(3-metylbutan-1-ol)
3. Tính chất vật lý
- Tan nhiều trong nước do tạo được liên kết H với nước. Độ tan trong nước giảm dần khi số nguyên tử C tăng lên.
4. Tính chất hóa học
a. Phản ứng thế H của nhóm OH
* Tính chất chung của ancol
2C2H5OH + 2Na → 2C2H5ONa + H2↑
* Tính chất đặc trưng của ancol đa chức có hai nhóm OH liền kề
- Hòa tan được Cu(OH)2 ở điều kiện thường tạo thành dung dịch màu xanh lam. Phản ứng này dùng để nhận biết ancol đa chức có hai nhóm OH liền kề.
2C3H5(OH)3 + Cu(OH)2 → [C3H5(OH)2O]2Cu + 2H2O
b. Phản ứng thế nhóm OH
* Phản ứng với axit vô cơ
C2H5 - OH + H-Br → C2H5Br + H2O
* Phản ứng với ancol
2C2H5OH\(\xrightarrow{{{\mathrm{H}}_{\mathrm{2}}}\mathrm{S}{{\mathrm{O}}_{\mathrm{4}}}\mathrm{, 14}{{\mathrm{0}}^{\mathrm{0}}}\mathrm{C}}\)C2H5OC2H5 + H2O
- PTTQ: 2ROH\(\xrightarrow{{{\mathrm{H}}_{\mathrm{2}}}\mathrm{S}{{\mathrm{O}}_{\mathrm{4}}}\mathrm{, 14}{{\mathrm{0}}^{\mathrm{0}}}\mathrm{C}}\) R-O-R + H2O
c. Phản ứng tách nước
C2H5OH \(\xrightarrow{{{\mathrm{H}}_{\mathrm{2}}}\mathrm{S}{{\mathrm{O}}_{\mathrm{4}}}\mathrm{, 17}{{\mathrm{0}}^{\mathrm{0}}}\mathrm{C}}\) C2H4 + H2O
- PTTQ:
CnH2n+1OH \(\xrightarrow{{{\mathrm{H}}_{\mathrm{2}}}\mathrm{S}{{\mathrm{O}}_{\mathrm{4}}}\mathrm{, 17}{{\mathrm{0}}^{\mathrm{0}}}\mathrm{C}}\) CnH2n+ H2O
d. Phản ứng oxi hóa:
- Oxi hóa không hoàn toàn:
+ Ancol bậc 1 khi bị oxi hóa bởi CuO/to cho ra sản phẩm là andehit
RCH2OH + CuO \(\xrightarrow{{{\mathrm{t}}^{\mathrm{0}}}}\) RCHO + Cu↓ + H2O
+ Ancol bậc hai khi bị oxi hóa bởi CuO/to cho ra sản phẩm là xeton.
R-CH(OH)-R’ + CuO \(\xrightarrow{{{\mathrm{t}}^{\mathrm{0}}}}\) R-CO-R’ +Cu↓ + H2O
+ Ancol bậc III khó bị oxi hóa.
- Oxi hóa hoàn toàn:
CnH2n+1OH + O2 \(\xrightarrow{{{\mathrm{t}}^{\mathrm{0}}}}\) nCO2 + (n+1)H2O
5. Điều chế:
a. Phương pháp tổng hợp:
- Điều chế từ anken tương ứng:
CnH2n + H2O \(\xrightarrow{{{\mathrm{H}}_{\mathrm{2}}}\mathrm{S}{{\mathrm{O}}_{\mathrm{4}}}\mathrm{, }{{\mathrm{t}}^{\mathrm{0}}}}\) CnH2n+1OH
- Điều chế Glixerol đi từ anken tương ứng là CH2=CH-CH3.
b. Phương pháp sinh hóa: Điều chế C2H5OH từ tinh bột.
(C6H10O5)n \(\xrightarrow[{{\mathrm{t}}^{\mathrm{0}}}\mathrm{, xt}]{\mathrm{+}{{\mathrm{H}}_{\mathrm{2}}}\mathrm{O}}\) C6H12O6
C6H12O6 \(\xrightarrow{\mathrm{enzim}}\) 2C2H5OH + 2CO2
II. PHENOL
1. Định nghĩa - Phân loại - Danh pháp
a. Định nghĩa: Phenol là những hợp chất hữu cơ trong phân tử có nhóm -OH liên kết trực tiếp với nguyên tử C vòng benzen.
- Ví dụ: C6H5OH (phenol) . . .
b. Phân loại:
- Phenol đơn chức: Phân tử có một nhóm -OH phenol.
- Phenol đa chức: Phân tử chứa hai hay nhiều nhóm -OH phenol.
c. Danh pháp: Số chỉ vị trí nhóm thế + phenol
2. Tính chất hóa học:
a. Phản ứng thế nguyên tử H của nhóm OH
- Tác dụng với kim loại kiềm
2C6H5OH + 2Na → 2C6H5ONa + H2↑
- Tác dụng với dung dịch bazơ
C6H5OH + NaOH → C6H5ONa + H2O
b. Phản ứng thế H của vòng benzen: Tác dụng với dung dịch Brom (Phản ứng này dùng để nhận biết phenol).
C6H5OH + 3Br2 → C6H2Br3OH↓ + 3HBr
3. Điều chế: Để điều chế phenol ta có sơ đồ sau:
C6H6 → C6H5Br → C6H5ONa → C6H5OH
C. ANDEHIT - XETON - AXIT CACBOXYLIC
I. ANDEHIT
1. Định nghĩa - Danh pháp
a. Định nghĩa: Andehit là những hợp chất hữu cơ mà phân tử có nhóm -CH=O liên kết trực tiếp với nguyên tử C hoặc nguyên tử H.
- Ví dụ: HCHO, CH3CHO...
b. Danh pháp:
- Tên thay thế của các andehit no đơn chức mạch hở như sau:
Tên hidrocacbon no tương ứng với mạch chính + al
Ví dụ: \(\overset{\mathrm{4}}{\mathop{\mathrm{C}}}\,{{\mathrm{H}}_{\mathrm{3}}}\overset{\mathrm{3}}{\mathop{\mathrm{C}}}\,\mathrm{H(C}{{\mathrm{H}}_{\mathrm{3}}}\mathrm{)}\overset{\mathrm{2}}{\mathop{\mathrm{C}}}\,{{\mathrm{H}}_{\mathrm{2}}}\overset{\mathrm{1}}{\mathop{\mathrm{C}}}\,\mathrm{HO}\) (3-metylbutanal)
- Tên thường của một số anđehit: Andehit + tên axit tương ứng
Ví dụ: HCHO (andehit fomic), CH3CHO (andehit axetic) . . .
2. Tính chất hóa học
- Vừa thể hiện tính oxi hóa, vừa thể hiện tính khử
a. Tính oxi hóa: Phản ứng cộng H2 (tạo thành ancol bậc I):
RCHO + H2 \(\xrightarrow{\mathrm{Ni, }{{\mathrm{t}}^{\mathrm{0}}}}\) RCH2OH
b. Tính khử: Tác dụng với các chất oxi hóa
R-CHO +2AgNO3+H2O +3NH3 \(\xrightarrow{{{\mathrm{t}}^{\mathrm{0}}}}\) R-COONH4+2Ag↓+2NH4NO3
R-CHO + 2Cu(OH)2+NaOH \(\xrightarrow{{{\mathrm{t}}^{\mathrm{0}}}}\) RCOONa +Cu2O↓ +3H2O
Các phản ứng trên dùng để nhận biết andehit.
3. Điều chế
- Để điều chế andehit ta đi từ ancol bằng phản ứng oxi hóa không hoàn toàn.
CH3CH2OH+ CuO\(\xrightarrow{{{\mathrm{t}}^{\mathrm{0}}}}\)CH3CHO +Cu +H2O
- Đi từ hidrocacbon.
2CH2=CH2 +O2 \(\xrightarrow{\mathrm{xt, }{{\mathrm{t}}^{\mathrm{0}}}}\) 2CH3CHO
II. XETON
1. Định nghĩa
- Là những hợp chất hữu cơ mà phân tử có nhóm liên kết trực tiếp với hai nguyên tử C.
-Ví dụ: CH3-CO-CH3 (đimetyl xeton), CH3-CO-C6H5 (metyl phenyl xeton) . . .
2. Tính chất hóa học
- Cộng H2 tạo thành ancol bậc II.
R-CO-R’ + H2 \(\xrightarrow{\mathrm{Ni, }{{\mathrm{t}}^{\mathrm{0}}}}\) RCH(OH)R’
CH3-CO-CH3 + H2 \(\xrightarrow{\mathrm{Ni, }{{\mathrm{t}}^{\mathrm{0}}}}\)CH3CH(OH)CH3
- Xeton không tham gia phản ứng tráng gương.
3. Điều chế
- Oxi hóa không hoàn toàn ancol bậc II.
CH3CH(OH)CH3+ CuO \(\xrightarrow{{{\mathrm{t}}^{\mathrm{0}}}}\) CH3-CO-CH3+ Cu + H2O
III. AXIT CACBOXYLIC
1. Định nghĩa - Danh pháp
a. Định nghĩa
- Là những phân tử hợp chất hữu cơ mà phân tử có nhóm -COOH liên kết trực tiếp với nguyên tử C hoặc nguyên tử H.
- Ví dụ: HCOOH, CH3COOH, . . .
b. Danh pháp
- Tên thay thế của các axit cacboxylic no, đơn chức, mạch hở như sau:
Axit + tên hidrocacbon no tương ứng với mạch chính + oic
- Ví dụ: \(\overset{\mathrm{5}}{\mathop{\mathrm{C}}}\,{{\mathrm{H}}_{\mathrm{3}}}\overset{\mathrm{4}}{\mathop{\mathrm{C}}}\,\mathrm{H(C}{{\mathrm{H}}_{\mathrm{3}}}\mathrm{)}\overset{\mathrm{3}}{\mathop{\mathrm{C}}}\,{{\mathrm{H}}_{\mathrm{2}}}\overset{\mathrm{2}}{\mathop{\mathrm{C}}}\,{{\mathrm{H}}_{\mathrm{2}}}\overset{\mathrm{1}}{\mathop{\mathrm{C}}}\,\mathrm{OOH}\) (Axit-4-metylpentanoic)
2. Tính chất vật lý
- Axit tan nhiều trong nước do tạo được liên kết hidro với nước và độ tan giảm dần khi số nguyên tử C tăng lên.
- Nhiệt độ sôi cao hơn ancol tương ứng do liên kết hidro giữa các nguyên tử bền hơn liên kết H giữa các phân tử ancol.
3. Tính chất hóa học
a. Tính axit: Có đầy đủ tính chất của một axit.
CH3COOH + NaOH → CH3COONa + H2O
2CH3COOH + ZnO → (CH3COO)2Zn + H2O
2CH3COOH + CaCO3 → (CH3COO)2Ca + CO2↑ +H2O
2CH3COOH + Zn →(CH3COO)2Zn +H2↑
b. Phản ứng thế nhóm -OH (phản ứng este hóa):
RCOOH + R’OH \(\overset{{{\mathrm{H}}^{\mathrm{+}}}\mathrm{, }{{\mathrm{t}}^{\mathrm{0}}}}{→}\) RCOOR’ + H2O
CH3COOH + C2H5OH\(\overset{{{\mathrm{H}}^{\mathrm{+}}}\mathrm{, }{{\mathrm{t}}^{\mathrm{0}}}}{→}\) CH3COOC2H5 + H2O
4. Điều chế axit axetic
a. Lên men giấm
C2H5OH + O2 \(\xrightarrow{men giấm}\) CH3COOH + H2O
b. Oxi hóa andehit axetic
2CH3CHO + O2 \(\xrightarrow{\mathrm{xt}}\) 2CH3COOH
c. Từ metanol
CH3OH + CO \(\xrightarrow{{{\mathrm{t}}^{\mathrm{0}}}\mathrm{, xt}}\) CH3COOH
Đây là phương pháp hiện đại sản xuất axit axetic.
Nguồn: Sưu tầm
Search google: "từ khóa + timdapan.com" Ví dụ: " Đề cương ôn tập học kỳ II môn Hóa lớp 11 timdapan.com"