Đề thi Hóa học kì 2 lớp 10 năm 2020 - Đề số 7 được TimDapAnbiên soạn gửi tới các bạn là đề thi học kì 2 Hóa học 10 có đáp án kèm theo. Nội dung câu hỏi đề thi bám sát cấu trúc ôn tập Hóa học 10. Câu hỏi được chia ở các mức độ khác nhau, giúp đánh đánh giá đúng năng lực học tập cũng như củng cố, luyện tập các câu hỏi, bài tập để chuẩn bị tốt cho kì thi.
Trắc nghiệm hóa 10 học kì 2 có đáp án - Đề số 7
Đề kiểm tra Hóa học kì 2 lớp 10
Bản quyền thuộc về TimDapAnnghiêm cấm mọi hành vi sao chép vì mục đích thương mại
(Cho Fe = 56; Na = 23; Ca = 40; Mg = 24; Mn = 55; Cu = 64; Al = 27, Zn = 65, S = 32, O = 16; Cl = 35,5; Ag = 108; H = 1)
Câu 1. Khí A được người dùng khử trùng cho nước sinh hoạt. Khí A là
A. SO2.
B. O2.
C. Cl2.
D. N2.
Câu 2. Có 4 dung dịch KF, KCl, KBr, KI đựng trong các lọ bị mất nhãn. Nếu dùng dung dịch AgNO3 thì có thể nhận biết được
A. 4 dung dịch.
B. 3 dung dịch.
C. 2 dung dịch.
D. 1 dung dịch.
Câu 3. Để đựng dung dịch axit HF người ta sử dụng loại bình nào?
A. Bình thuỷ tinh màu xanh.
B. Bình thuỷ tinh mầu nâu.
C. Bình thuỷ tinh không màu.
D. Bình nhựa dẻo
Câu 4. Đốt cháy hoàn toàn m gam Mg trong khí Cl2 dư, thu được 9,5 gam muối. Giá trị của m là:
A. 2,4 gam
B. 2,80 gam
C. 4,8 gam
D. 1,2 gam
Câu 5. Hỗn hợp khí nào dưới đây không tồn tại ở nhiệt độ thường?
A. H2 và F2.
B. S và O2.
C. H2S và N2.
D. CO và O2.
Câu 6. Cho 25,5 gam hỗn hợp X gồm CuO và Al2O3 tan hoàn toàn trong dung dịch H2SO4 loãng, thu được dung dịch chứa 57,9 gam muối. Phần tẳm khối lượng của Al2O3 trong X là
A. 60%
B. 40%
C. 80%
D. 20%
Câu 7. Cho lượng dư MnO2 vào 200 ml dung dịch HCl 2M. Thể tích khí Cl2 sinh ra (đktc) là:
A. 3,36 lít.
B. 1,45 lít.
C. 2,24 lít.
D. 4,48 lít.
Câu 8. Dãy chất nào dưới đây tác dụng được với axit HCl: KOH (1), (2), Ag (3), Al(OH)3 (4), KMnO4 (5), K2SO4 (6). Axit HCl tác dụng được với các chất:
A. KOH, Zn, Al(OH)3, KMnO4
B. Ag, Al(OH)3, KMnO4, K2SO4
C. KOH, Zn, Ag, Al(OH)3
D. KOH, Zn, Ag,KMnO4
Câu 9. Khi sục SO2 vào dung dịch H2S thì
A. Dung dịch bị vẩn đục màu vàng.
B. Không có hiện tượng gì.
C. Dung dịch chuyển thành màu nâu đen.
D. Tạo thành chất rắn màu đỏ.
Câu 10. Để làm khô khí SO2 có lẫn hơi nước,người ta dùng:
A. H2SO4 đặc
B. CuO
C. CaO
D. dung dịch NaOH
Câu 11. Dẫn 1,12 lít khí SO2 (đktc) vào 200ml dung dịch NaOH 1M, dung dịch được có chứa
A. NaHSO3
B. NaHSO3 và Na2SO3
C. Na2SO3 và NaOH
D. Na2SO3
Câu 12. Để điều chế clo trong phòng thí nghiệm, cần dùng các hóa chất:
A. KMnO4 và NaCl
B. MnO2 và dung dịch HCl đặc
C. NaCl và nước
D. Cho H2 tác dụng với Cl2 có ánh sáng
Câu 13. Nung nóng hỗn hợp gồm 5,6 gam Fe với 4 gam bột S trong bình kín một thời gian thu được hỗn hợp X gồm FeS, FeS2, Fe và S dư. Cho X tan hết trong dung dịch H2SO4 đặc nóng dư thu được V lít khí SO2 ( ở đktc, sản phẩm khử duy nhất ). Giá trị của V là
A. 8,96 lít
B. 11,65 lít
C. 3,36 lít
D. 11,76 lít
Câu 14. Cặp chất nào sau đây không tác dụng với Oxi ở điều kiện thường?
A. P, S
B. Fe, Cu
C. C, H2
D. Ag, Pt
Câu 15. Hòa tan hoàn toàn 17,4 gam hỗn hợp kim loại X gồm Mg, Al và Cu bằng dung dịch H2SO4 đặc, nóng thu được dung dịch Y và thoát ra 12,32 lít SO2 (ở đktc, sản phẩm khử duy nhất ). Cô cạn dung dịch Y được m gam muối khan. Giá trị của m là
A. 52,6
B. 70,2
C. 71,3
D. 67,4
Câu 16. Dãy chất nào sau đây chỉ có tính oxi hoá?
A. O2, SO2, Cl2, H2SO4
B. S, F2, H2S, O3
C. O3, F2, H2SO4
D. HCl, H2S, SO2,SO3
Câu 17. Cho phản ứng: Al + H2SO4 đặc → Al2(SO4)3 + H2S + H2O. Tổng hệ số tối giản (nguyên) trong phản ứng là:
A. 42
B. 50
C. 55
D. 52
Câu 18. Đun hỗn hợp gồm 5,6 g bột sắt (Fe) và 3,2 g lưu huỳnh (S) đến khi phản ứng kết thúc thu được chất rắn màu đen A. Hòa tan hoàn toàn A bằng dung dịch HCl thu được một dung dịch muối B và V lít (đktc) khí C. Khí C và V lần lượt là:
A. H2 và 2,24 lít.
B. H2S và 2,24 lít.
C. SO2 và 22,4 lít.
D. SO2 và 2,24 lít.
Câu 19. Hòa tan hoàn toàn 6,5 g kẽm (Zn) bằng dung dịch axit H2SO4 loãng, thu được V lít khí H2 (ở đktc). Giá trị của V là
A. 11,2 lít.
B. 2,24 lít.
C. 1,12 lít.
D. 22,4 lít.
Câu 20. Cho phản ứng hóa học
H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl
A. H2S là chất khử, H2O là chất oxi hóa.
B. Cl2 là chất oxi hóa, H2S là chất khử.
C. Cl2 là chất oxi hóa, H2O là chất khử.
D. H2S là chất oxi hóa, Cl2 là chất khử.
Câu 21. Trong các phát biểu sau, phát biểu nào phù hợp với một phản ứng thuận nghịch ở trạng thái cân bằng?
A. Phản ứng thuận đã kết thúc
B. Phản ứng nghịch đã kết thúc
C. Cả phản ứng thuận và phản ứng nghịch đã kết thúc
D. Tốc độ pahnr ứng thuận bằng tốc dộ phản ứng nghịch
Câu 22. Cho 200ml dung dịch Na2SO4 0,5M vào 300ml dung dịch BaCl2 0,5M. Sau phản ứng thu được dung dịch A và m gam kết tủa BaSO4. Giá trị m là
A. 23,3 gam.
B. 34,95 gam.
C. 11,65 gam.
D. 46,6 gam.
Câu 23. Cho sơ đồ phản ứng: A1 → (X) → A2 → (Y) → NaNO3. X và Y có thể là
A. NaOH và NaClO.
B. Na2CO3 và NaClO.
C. NaClO3 và Na2CO3.
D. NaOH và Na2CO3.
Câu 24. Cho hệ cân bằng trong một bình kín: N2(k) + O2(k) ⇌ 2NO(k); ∆H >0 Cân bằng trên chuyển dịch theo chiều thuận khi
A. thêm chất xúc tác vào hệ.
B. giảm áp suất của hệ.
C. thêm khí NO vào hệ.
D. tăng nhiệt độ của hệ.
Câu 25. Cho cân bằng hóa học: 2SO2 (k) + O2 (k) ⇌ 2SO3 (k)
Yếu tố nào sau đây không làm nồng độ các chất trong hệ cân bằng biến đổi?
A. biến đổi nhiệt độ
B. biến đổi áp suất
C. sự có mặt chất xúc tác
D. biến đổi dung tích của bình phản ứng
Đáp án đề kiểm tra Hóa học kì 2 lớp 10
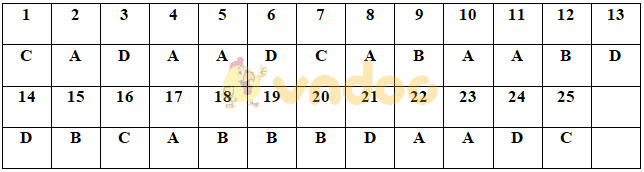
Mời các bạn tham khảo thêm một số đề thi học kì 2 Hóa học 10 mới nhất tại Tìm Đáp Án
- Đề thi lớp 10 cuối kì 2 năm 2020 môn Hóa học (số 1)
- Đề thi lớp 10 cuối kì 2 năm 2020 môn Hóa học (số 2)
- Đề thi Hóa học kì 2 lớp 10 năm 2020 - Đề số 5
- Đề thi Hóa học kì 2 lớp 10 năm 2020 - Đề số 6
TimDapAnđã giới thiệu Đề thi Hóa học kì 2 lớp 10 năm 2020 - Đề số 7 có đáp án, toàn bộ đề thi là 25 câu hỏi trắc nghiệm, nội dung chương trình Hóa học 10 kì 2, các dạng bài tập câu hỏi lí thuyết, bài tập tính toán từng cấp độ được đan xen trong bài. Giúp các em có thể luyện tập thao tác tính toán, tự tin khi làm bài kiểm tra cuối kì 2.











