Đề thi học kì 1 môn Hóa học lớp 10
Đề thi học kì 1 môn Hóa học lớp 10 trường THPT Phan Ngọc Hiển, Cà Mau năm học 2015 - 2016 là tài liệu ôn tập môn Hóa lớp 10 hay dành cho các em học sinh tham khảo, ôn luyện kiến thức môn Hóa với các dạng bài tập đa dạng, giúp các em chuẩn bị tốt cho kì thi học kì I. Chúc các em thi tốt trong các kì thi sắp tới.
Đề thi học kì 1 môn Hóa học lớp 10 trường THPT Núi Thành, Quảng Nam năm học 2015 - 2016
|
SỞ GIÁO DỤC VÀ ĐÀO TẠO CÀ MAU Trường THPT Phan Ngọc Hiển (ĐỀ 01) |
ĐỀ KIỂM TRA HỌC KÌ I Môn: Hóa Học 10 Thời gian làm bài: 45 phút |
A. Trắc nghiệm: (chọn đáp án đúng nhất)
Câu 1: Phát biểu nào dưới đây không đúng:
A. Hầu hết các nguyên tử được cấu tạo từ các hạt cơ bản là electron, proton, nơtron.
B. Nguyên tử có cấu tạo đặc khít, gồm vỏ nguyên tử và hạt nhân nguyên tử.
C. Hạt nhân nguyên tử được tạo bởi các hạt proton và nơtron.
D. Vỏ nguyên tử cấu tạo bởi các hạt electron.
Câu 2: Trong tự nhiên Clo có hai đồng vị bền là 35Cl và 37Cl. Nguyên tử khối trung bình của Cl là 35,5. Phần trăm của 35Cl trong tự nhiên là
A. 50%. B. 70%. C. 75%. D. 80%.
Câu 3: Cấu hình e nguyên tử nào sau đây là không đúng:
A. 1s2 2s1 B. 1s2 2s2 2p6 3s2 3p6 3d1
C. 1s2 2s2 2p6 3s2 D. 1s2 2s2 2p6 3s2 3p6 4s1
Câu 4: Số proton, notron và electron của 3919K lần lượt là:
A. 19, 20, 39 B. 20, 19, 39 C. 19, 20, 19 D. 19, 19, 20.
Câu 5: Ion X có cấu hình eletron của phân lớp ngoài cùng là 3p6. Vị trí của R trong bảng tuần hoàn là?
A. Ô số 18, chu kì 3, nhóm VIIIA. B. Ô số 18, chu kì 3, nhóm VIA.
C. Ô sô 17, chu kì 3, nhóm VIIA. D. Ô số 19, chu kì 4, nhóm IA..
Câu 6: R thuộc chu kì 3, nhóm VA. Số electron lớp ngoài cùng của R là:
A. 3 B. 4 C. 2 D. 5
Câu 7: Tính chất nào của các nguyên tố trong bảng tuần hoàn, không biến đổi tuần hoàn:
A. Số electron ở lớp ngoài cùng B. Độ âm điện.
C. Điện tích hạt nhân. D. Bán kính nguyên tử.
Câu 8: Tính bazơ của các hiđroxyt tương ứng của 19K, 12Mg, 11Na, giảm dần theo thứ tự:
A. KOH, Mg(OH)2, NaOH B. Mg(OH)2, NaOH, KOH
C. Mg(OH)2, KOH, NaOH D. NaOH, KOH, Mg(OH)2.
Câu 9: Số oxy hóa của nitơ trong dãy các chất và ion sau: NH4+, NO3-, HNO3, NO, NO2 lần lượt là:
A. -5, +5, +4, +2,+4 B. -4, +5, +5, +2, +4
C. -3, +5, +5, +2, +4 D. -3, +6, +5, +2, +4.
Câu 10: Liên kết ion là liên kết được hình thành do
A. Lực hút tĩnh điện giữa ion dương và electron
B. Lực hút của các ion dương với nhau.
C. Lực hút của các ion âm với nhau
D. Lực hút tĩnh điện giữa ion dương với ion âm.
Câu 11: Chất nào sau có liên kết cộng hóa trị
A. Na2O B. H2O C. CaO D. MgCl2
Câu 12: Khi cho 0,6 gam một kim loại thuộc nhóm IIA tác dụng với nước thì có 0,336 lít khí thoát ra ở đktc. Kim loại đó là:
A.Ca(40) B. Na(23) C. Ba(137) D. K(39)
B. Tự luận:
Bài 1: (2,0đ) Cho nguyên tố: S (Z = 16)
a) Xác định vị trí của S trong bảng tuần hoàn(có giải thích).
b) Nêu tính chất hóa học cơ bản của S.
Bài 2: (1,5đ) Tổng số hạt trong một nguyên tử của nguyên tố A là 52. Trong hạt nhân nguyên tử số hạt mang điện ít hơn số hạt không mang điện là 1. Viết kí hiệu nguyên tử của nguyên tố A.
Bài 3: (1,5đ) Hợp chất khí với hiđro của một nguyên tố R ứng với công thức RH4. Oxít cao nhất của nó có chứa 72,73% oxi theo khối lượng. Tìm tên nguyên tố R.
Bài 4: (1.0 đ) Xác định hóa trị các nguyên tố trong các hợp chất sau: CaCl2, CH4
Bài 5: (1.0 đ) Viết công thức electron và công thức cấu tạo cúa: O2, H2O
(Học sinh không được sử dung bảng tuần hoàn các nguyên tố hóa học)
Đáp án đề thi học kì 1 môn Hóa học lớp 10
A. Trắc nghiệm
1. B 2. C 3. B 4. C 5. C 6. D
7. C 8. B 9. C 10. D 11. B 12. A
B. Tự luận:
Bài 1:
a. Cấu hình electron của S: 1s2 2s2 2p6 3s2 3p4
- S ở ô 16 (có Z = 16)
- S ở chu kì 3 (có 3 lớp e)
- S ở nhóm VIA (có 6e ở lớp ngoài cùng)
b. S có tính phi kim (ở nhóm VIA)
- S có hóa trị cao nhất trong hợp chất với oxi là 6 → công thức oxit cao nhất SO3.
- S có hóa trị 2 trong hợp chất khí với hiđro → công thức hợp chất khí là H2S
- Công thức hiđroxit H2SO4: có tính axit mạnh.
Bài 2
Tổng số hạt: p + e + n = 52
Và n - p = 1
Giai tìm p = e = 17 → Z = 17
n = 17 + 1 = 18
Số khối A = Z + N = 35
Kí hiệu nguyên tử: ![]() hay
hay ![]()
Bài 3:
Công thức hợp chất với hidro là RH4
→ R thuộc nhóm IVA
→ Công thức oxit cao nhất RO2
R chiếm 100 - 72,73 = 27,27%
2 O chiếm 72,73%
Tìm MR ≈ 12.
Vậy R là Cacbon (C)
Bài 4:
CaCl2: Ca có điện hóa trị là 2+
Cl có điện hóa trị là 1-
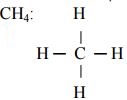
Bài 5:
Viết đúng công thức electron mỗi chất.
Viết đúng công thức cấu tạo mỗi chất.











