Đề thi giữa học kì 2 môn Hóa học lớp 11
Đề thi giữa học kì 2 môn Hóa học lớp 11 trường THPT Yên Lạc 2, Vĩnh Phúc năm học 2016 - 2017 là đề kiểm tra môn Hóa lớp 11 có đáp án đi kèm. Đây sẽ là tài liệu ôn tập môn Hóa lớp 11 hữu ích dành cho các bạn, giúp các bạn củng cố kiến thức, ôn thi học kì II hiệu quả.
- Bài tập tự luận môn Hóa học lớp 11 - Chương 4: Đại cương về hóa học hữu cơ
- Danh pháp các hợp chất hữu cơ
- 5 đề kiểm tra học kì 2 lớp 11 môn Hóa học
|
SỞ GD & ĐT VĨNH PHÚC TRƯỜNG THPT YÊN LẠC 2 ------------------
|
KỲ THI KSCL LẦN 2 NĂM HỌC 2016-2017 ĐỀ THI MÔN HÓA HỌC KHỐI 11 Thời gian làm bài: 60 phút, không kể thời gian giao đề Đề thi gồm 4 trang |
|
|
|
Mã đề thi 132 |
|
Cho KLNT: H = 1, C= 12, N = 14, O = 16, Na = 23, Mg = 24, Al = 27, P = 31, S = 32, K = 39, Ca = 40, Cl = 35,5; Fe = 56, Zn = 65, Br = 80, Ag = 108, Ba = 137
Câu 1: Hai chất nào sau đây cùng tồn tại trong một dung dịch?
A. NaOH và H2SO4.
B. K2S và HCl.
C. KNO3 và CuSO4.
D. MgCl2 và Na2CO3.
Câu 2: Propin (CH3-C≡CH) tạo kết tủa vàng nhạt với chất nào sau đây?
A. Dung dịch brom.
B. Dung dịch HBr.
C. Dung dịch KMnO4.
D. Dung dịch AgNO3/NH3.
Câu 3: Buta-1,3-đien dùng làm nguyên liệu để sản xuất cao su tổng hợp như: cao su buna, cao su buna-S,....Công thức cấu tạo của buta-1,3- đien là
A. CH2=CH-C2H5.
B. CH2=CH2.
C. CH2=CH-CH=CH2.
D. CH2=C(CH3)CH=CH2.
Câu 4: Chất nào dưới đây không phải là chất điện li?
A. KOH
B. BaCl2
C. CH3COOH.
D. C2H5OH.
Câu 5: X là hỗn hợp 2 hiđrocacbon mạch hở, cùng dãy đồng đẳng. Để đốt cháy hết 2,8 gam X cần 6,72 lít O2 (đktc). Hấp thụ toàn bộ sản phẩm cháy vào nước vôi trong dư được m gam kết tủa. Giá trị m là
A. 20 gam.
B. 30 gam.
C. 15 gam.
D. 25 gam.
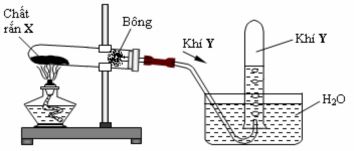
Câu 6: Cho hình vẽ mô tả thí nghiệm điều chế khí Y từ chất rắn X như sau:
Hình vẽ trên minh họa cho phản ứng nào sau đây?
A. CaC2 + 2H2O → Ca(OH)2 + C2H2
B. NH4Cl NH3 + HCl
C. BaSO3 BaO + SO2
D. 2KMnO4 K2MnO4 + MnO2 + O2
Câu 7: Hoà tan hoàn toàn 5,2 gam kim loại M vào dung dịch HNO3 dư thu được 1,008 lít (đktc) hỗn hợp 2 khí NO và N2O là sản phẩm khử duy nhất. Sau phản ứng khối lượng dung dịch tăng lên 3,78 gam so với ban đầu. Kim loại M là
A. Zn.
B. Fe.
C. Al.
D. Mg.
Câu 8: Thực hiện phản ứng crackinh m gam isobutan thu được hỗn hợp X chỉ có các hiđrocacbon. Dẫn hỗn hợp X qua dung dịch chứa 6,4 gam brom, thấy brom phản ứng hết và có 4,704 lít hỗn hợp khí Y (đktc) thoát ra. Tỉ khối hơi của Y so với H2 là 117/7. Giá trị của m là
A. 9,28.
B. 8,12.
C. 8,70.
D. 10,44.
Câu 9: Nhỏ rất từ từ dung dịch HCl vào dung dịch chứa a mol KOH, b mol NaOH và c mol K2CO3, kết quả thí nghiệm được biểu diễn trên đồ thị sau:
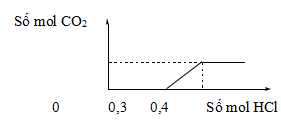
Tổng (a + b) có giá trị là
A. 0,1.
B. 0,3.
C. 0,2.
D. 0,4.
Câu 10: Ở điều kiện thích hợp xảy ra các phản ứng sau:
(a) 2C + Ca → CaC2
(b) C + 2H2 → CH4
(c) C + CO2 → 2CO
(d) 3C + 4Al → Al4C3
Trong các phản ứng trên, tính khử của cacbon thể hiện ở phản ứng
A. (c)
B. (b)
C. (a)
D. (d)
Câu 11: Hòa tan hoàn toàn hỗn hợp X gồm BaO, NH4HCO3, NaHCO3 (có tỷ lệ mol lần lượt là 5 : 4 : 2) vào nước dư, đun nóng. Đến khi các phản ứng xảy ra hoàn toàn thu được dung dịch Y chứa :
A. NaHCO3 và Ba(HCO3)2.
B. Na2CO3.
C. NaHCO3.
D. NaHCO3 và (NH4)2CO3.
Câu 12: Chất nào sau đây là đồng phân của CH3COOCH3?
A. CH3COCH3.
B. CH3CH2COOH.
C. C2H5OH.
D. C2H5OCH3.
Câu 13: Liên kết trong phân tử NH3 là
A. Liên kết cộng hóa trị phân cực.
B. Liên kết ion.
C. Liên kết cộng hóa trị không cực.
D. Liên kết cho- nhận.
Câu 14: Chất nào sau đây có đồng phân hình học?
A. CHCl=CHBr.
B. CH2=CH2.
C. CH≡CH.
D. (CH3)2C=C(CH3)2.
Câu 15: Cho bột Fe vào dung dịch NaNO3 và H2SO4. Đến phản ứng hoàn thu được dung dịch A, hỗn hợp khí X gồm NO và H2 có và chất rắn không tan. Biết dung dịch A không chứa muối amoni. Trong dung dịch A chứa các muối:
A. FeSO4, Fe2(SO4)3, NaNO3, Na2SO4.
B. FeSO4, Fe(NO3)2, Na2SO4, NaNO3.
C. FeSO4, Na2SO4.
D. FeSO4, Fe(NO3)2, Na2SO4.
Câu 16: Hai chất 2- metylpropan và butan khác nhau về
A. số nguyên tử cacbon.
B. số liên kết cộng hóa trị.
C. công thức cấu tạo.
D. công thức phân tử.
Câu 17: CO khử được oxit kim loại nào sau đây?
A. Al2O3.
B. BaO.
C. Fe2O3.
D. MgO.
Câu 18: Thuốc thử thích hợp dùng để nhận biết các chất sau ở các lọ riêng biệt: etan, etilen và axetilen là:
A. dung dịch AgNO3/NH3 và dung dịch brom.
B. Dung dịch AgNO3/NH3.
C. dung dịch KMnO4.
D. dung dịch HCl.
Câu 19: Cho ankin X có công thức cấu tạo sau:
Tên của X là ![]()
A. 2-metylpent-3-in.
B. 4-metylpent-2-in.
C. 4-metylpent-3-in.
D. 2-metylpent-4-in.
Câu 20: Cho các chất sau: metan, axetilen, isopren, isopentan, vinylaxetilen, butan và buta-1,3-đien. Số chất làm mất màu dung dịch brom ở nhiệt độ thường là
A. 5.
B. 6.
C. 3.
D. 4.
Câu 21: Cho 9,94 gam H3PO4 tác dụng với 253,5 ml dung dịch NaOH 2M, sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch X. Các chất trong X là
A. NaH2PO4 và H3PO4.
B. NaH2PO4 và Na2HPO4.
C. Na3PO4 và NaOH.
D. Na2HPO4 và Na3PO4.
Câu 22: Khi được chiếu sáng, hiđrocacbon nào sau đây tham gia phản ứng thế với clo theo tỉ lệ mol 1 : 1, thu được ba dẫn xuất monoclo là đồng phân cấu tạo của nhau?
A. isopentan.
B. pentan.
C. neopentan.
D. butan.
Câu 23: HNO3 tinh khiết là chất lỏng không màu, nhưng dung dịch HNO3 để lâu thường ngả màu vàng là do
A. Dung dịch HNO3 có tính oxi hóa mạnh.
B. HNO3 tan nhiều trong nước.
C. Khi để lâu thì HNO3 bị khử bởi các chất của môi trường.
D. Dung dịch HNO3 có hòa tan một lượng nhỏ NO2.
Câu 24: Dung dịch X chứa 0,12 mol Na+; x mol ; 0,12 mol và 0,05 mol . Cho 300 ml dung dịch Ba(OH)2 0,1M vào X đến khi các phản ứng xảy ra hoàn toàn, lọc bỏ kết tủa, thu được dung dịch Y. Cô cạn Y, thu được m gam chất rắn khan. Giá trị của m là
A. 7,875.
B. 7,020.
C. 7,705.
D. 7,190.
Câu 25: Phản ứng nào sau đây có phương trình ion thu gọn là: 2H+ + S2- → H2S?
A. 2CH3COOH + K2S → 2CH3COOK + K2S
B. FeS + 2HCl → FeCl2 + H2S
C. CuS + H2SO4 (loãng) → CuSO4 + H2S
D. Na2S + 2HCl → 2NaCl + H2S
Câu 26: Cho isopren ( 2- metylbuta- 1,3- đien) phản ứng cộng với brom theo tỷ lệ 1: 1 về số mol. Hỏi có thể thu được tối đa mấy đồng phân cấu tạo có cùng công thức phân tử C5H8Br2?
A. 2.
B. 3.
C. 4.
D. 5.
Câu 27: Đốt cháy hoàn toàn 18g chất hữu cơ X cần vừa đủ 16,8 lít O2 thu được CO2 và hơi nước có tỷ lệ thể tích = 3: 2. Công thức phân tử của X là
A. C3H4O
B. C4H6O
C. C3H4O2
D. C4H6O2
Câu 28: Trộn 250 ml dung dịch hỗn hợp HCl 0,08 mol/l và H2SO4 0,01 mol/l với 250 ml dung dịch Ba(OH)2 có nồng độ x mol/l thu được m gam kết tủa và 500 ml dung dịch có pH = 12. Coi Ba(OH)2 điện li hoàn toàn cả hai nấc. Giá trị của m và x lần lượt là
A. 3,495 gam và 0,12M.
B. 0,5825gam và 0,06M.
C. 5,825 gam và 0,6M.
D. 3,495 gam và 0,06M.
Câu 29: Hỗn hợp X gồm H2 và C2H4 có tỉ khối so với H2 là 7,5. Dẫn X qua Ni nung nóng, thu được hỗn hợp Y có tỉ khối so với H2 là 12,5. Hiệu suất của phản ứng hiđro hóa là
A. 70%
B. 60%
C. 50%
D. 80%
Câu 30: SiO2 tan dễ trong chất nào sau đây?
A. Dung dịch NaOH loãng.
B. Dung dịch H2SO4 đặc.
C. Dung dịch Na2CO3.
D. dung dịch HF.
Câu 31: Cho sơ đồ chuyển hoá: ![]() . Các chất X, Y, Z lần lượt là:
. Các chất X, Y, Z lần lượt là:
A. K3PO4, K2HPO4, KH2PO4.
B. K3PO4 , KH2PO4, K2HPO4.
C. KH2PO4, K3PO4, K2HPO4.
D. KH2PO4, K2HPO4, K3PO4.
Câu 32: Hỗn hợp khí X gồm etilen và propin. Cho a mol X tác dụng với lượng dư dung dịch AgNO3 trong NH3 thu được 17,64 gam kết tủa. Mặt khác a mol X phản ứng tối đa với 0,44 mol H2. Giá trị của a là
A. 0,46.
B. 0,32.
C. 0,22.
D. 0,34.
Câu 33: Tiến hành các thí nghiệm sau: (1) Cho dung dịch AgNO3 vào dung dịch H3PO4; (2) Sục khí H2S vào dung dịch CuSO4; (3) Sục khí CO2 (dư) vào dung dịch CaOCl2; (4) Sục khí CO2 (dư) vào dung dịch Ca(OH)2; (5) Nhỏ từ từ dung dịch NH3 đến dư vào dung dịch AlCl3; (6) Nhỏ từ từ dung dịch Ba(OH)2 đến dư vào dung dịch Al2(SO4)3.
Sau khi các phản ứng xảy ra hoàn toàn, số thí nghiệm thu được kết tủa là
A. 5.
B. 4.
C. 3.
D. 6.
Câu 34: Hiện tượng gì xảy ra khi cho vụn đồng (Cu) và dung dịch H2SO4 vào dung dịch NaNO3, đun nhẹ?
A. Cu tan, dung dịch có màu vàng, có khí màu nâu đỏ bay ra.
B. Cu tan, dung dịch có màu xanh, có khí màu nâu đỏ bay ra.
C. Cu tan, dung dịch có màu xanh, có khí không màu bay ra.
D. Cu tan, dung dịch không màu, có khí màu vàng bay ra.
Câu 35: Cho các chất sau: CO2, NO2, CO, SiO2, P2O5, Si, Cl2. Có bao nhiêu chất tác dụng được với dung dịch NaOH loãng ở nhiệt độ thường?
A. 7.
B. 6.
C. 4.
D. 5.
Câu 36: Công thức phân tử của ankan là
A. CnH2n-2( n≥2).
B. CnH2n-2 ( n≥3).
C. CnH2n (n≥2).
D. CnH2n+2 (n≥1).
Câu 37: Một bình kín chứa hỗn hợp X gồm 0,06 mol axetilen; 0,09 mol vinylaxetilen; 0,16 mol H2 và một ít bột Ni. Nung hỗn hợp X thu được hỗn hợp Y gồm 7 hiđrocacbon (không chứa but -1-in) có tỉ khối hơi đối với H2 là 328/15. Cho toàn bộ hỗn hợp Y đi qua bình đựng dung dịch AgNO3/NH3 dư, thu được m gam kết tủa vàng nhạt và 1,792 lít (ở đktc) hỗn hợp khí Z thoát ra khỏi bình. Để làm no hoàn toàn hỗn hợp Z cần vừa đúng 50 ml dung dịch Br2 1M. Các phản ứng xảy ra hoàn toàn. Giá trị của m là
A. 14,37.
B. 15,18.
C. 13,56.
D. 28,71.
Câu 38: Hòa tan hết m gam chất rắn X gồm Fe, FeS, FeS2 bằng dung dịch HNO3 dư. Sau khi các phản ứng xảy ra hoàn toàn, thu được 4,48 lít (đktc) hỗn hợp sản phẩm khử chỉ gồm 2 khí NO và NO2 có tỉ khối so với H2 là 17,4 và dung dịch Y chỉ chứa hai chất tan. Cho Y tác dụng với dung dịch NaOH dư, lấy kết tủa làm khô cân được a gam. Giá trị của m và a lần lượt là:
A. 4,16 và 4,28.
B. 2,08 và 2,14.
C. 4,64và4,85.
D. 11,52 và 11,77.
Câu 39: Cho 4,32 gam Mg vào dung dịch hỗn hợp NaNO3 và H2SO4, đun nhẹ đến khi phản ứng xảy ra hoàn toàn thu được dung dịch X; 0,896 lít (đktc) hỗn hợp khí Y có khối lượng 0,92 gam gồm 2 khí không màu có một khí hóa nâu trong không khí và còn lại 2,04 gam chất rắn không tan. Cô cạn cẩn thận dung dịch X thu được m gam muối khan. Giá trị của m là
A. 18,27.
B. 14,90.
C. 14,86.
D. 15,75.
Câu 40: Nung nóng a mol hỗn hợp X gồm C2H2 và H2 trong bình kín có xúc tác thích hợp thu được hỗn hợp khí Y. Dẫn Y qua lượng dư dung dịch AgNO3 trong NH3, sau khi phản ứng hoàn toàn thu được 24 gam kết tủa và hỗn hợp khí Z. Hỗn hợp Z làm mất màu tối đa 40 gam brom trong dung dịch và còn lại hỗn hợp khí T. Đốt cháy hoàn toàn hỗn hợp T thu được 11,7 gam nước. Giá trị của a là
A. 1,25.
B. 0,80.
C. 1,50.
D. 1,00.
----------- HẾT ----------
(Cán bộ coi thi không giải thích gì thêm)
Họ và tên thí sinh:..................................................................... SBD: .............................
Đáp án đề thi giữa học kì 2 môn Hóa học lớp 11
|
1 |
C |
11 |
B |
21 |
C |
31 |
B |
|
2 |
D |
12 |
B |
22 |
B |
32 |
B |
|
3 |
C |
13 |
A |
23 |
D |
33 |
A |
|
4 |
D |
14 |
A |
24 |
A |
34 |
B |
|
5 |
A |
15 |
C |
25 |
D |
35 |
D |
|
6 |
D |
16 |
C |
26 |
B |
36 |
D |
|
7 |
A |
17 |
C |
27 |
C |
37 |
C |
|
8 |
C |
18 |
A |
28 |
B |
38 |
A |
|
9 |
C |
19 |
B |
29 |
D |
39 |
B |
|
10 |
A |
20 |
D |
30 |
D |
40 |
A |
..........................................................
Trên đây Tìm Đáp Án đã giới thiệu tới bạn đọc tài liệu: Đề thi giữa học kì 2 môn Hóa học lớp 11 trường THPT Yên Lạc 2, Vĩnh Phúc. Để có kết quả cao hơn trong học tập, TimDapAnxin giới thiệu tới các bạn học sinh tài liệu Hóa học lớp 10, Giải bài tập Hóa học lớp 11, Thi thpt Quốc gia môn Văn, Thi thpt Quốc gia môn Lịch sử, Thi thpt Quốc gia môn Địa lý, Thi thpt Quốc gia môn Toán, đề thi học kì 1 lớp 11, đề thi học kì 2 lớp 11 mà TimDapAntổng hợp và đăng tải.
Để tiện trao đổi, chia sẻ kinh nghiệm giảng dạy và học tập môn học THPT, TimDapAnmời các bạn truy cập nhóm riêng dành cho lớp 11 sau: Nhóm Tài liệu học tập lớp 11 để có thể cập nhật được những tài liệu mới nhất.