Đề thi giữa học kì 2 môn Hóa học lớp 11
Đề thi giữa học kì 2 môn Hóa học lớp 11 trường THPT Nguyễn Trãi, Thanh Hóa năm học 2015 - 2016 là tài liệu tham khảo chất lượng được chúng tôi sưu tầm, giúp các bạn học sinh thuận tiện hơn trong quá trình ôn tập và củng cố lại kiến thức chuẩn bị cho kì thi học kì II sắp tới.
Đề thi giữa học kì 2 môn Hóa học lớp 11 trường THPT Đào Duy Từ, Thanh Hóa năm học 2014 - 2015
|
TRƯỜNG THPT NGUYỄN TRÃI |
ĐỀ KIỂM TRA CHẤT LƯỢNG GIỮA HỌC KỲ II MÔN HOÁ HỌC LỚP 11 Năm học 2015 – 2016 Thời gian làm bài: 45 phút |
Câu 1. 4,0 điểm
Hoàn thành sơ đồ biến đổi sau (mỗi mũi tên là một phản ứng, ghi rõ điều kiện)
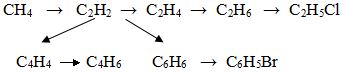
Câu 2. 2,0 điểm
Nhận biết các khí sau bằng phương pháp hóa học: C2H2, C2H4 và C2H6.
Câu 3. 2,0 điểm
Nêu tính chất hóa học của etilen và viết phương trình hóa học minh họa.
Câu 4. 2,0 điểm
Cho 6,72 lít (đktc) hỗn hợp khí gồm etilen và axetilen tác dụng hết với dung dịch Br2 thì cần tối đa 64 gam brom.
a. Viết các PTHH xảy ra.
b. Tính % số mol mỗi khí.
Cho nguyên tử khối: H = 1, C = 12, O = 16, N = 14, Mg = 24, Cl = 35,5, Br = 80
Lưu ý: Học sinh không được sử dụng bảng tuần hoàn các nguyên tố hoá học!
Đáp án đề thi giữa học kì 2 môn Hóa học lớp 11
Câu 1. 4,0 điểm
- CH4 → C2H2 +3H2
- C2H2 + H2 → C2H4
- C2H4 + H2 → C2H6
- C2H6 + Cl2 → C2H5Cl + HCl
- 2C2H2 → C4H4
- C4H4 + H2 → C4H6
- 3C2H2 → C6H6
- C6H6 + Br2 → C6H5Br
Nếu HS viết đúng mà thiếu đk thì được ½ số điểm!
Câu 2. 2,0 điểm
Lấy mỗi khí một ít để làm mẫu thử
Dùng dung dịch AgNO3/NH3 nhận biết được C2H2 có kết tủa vàng
C2H2 + 2AgNO3 + 2NH3→ Ag2C2 + NH4NO3
Dùng dung dịch Br2 nhận biết được C2H4.
C2H4 + Br2→ C2H4Br2
Còn lại là C2H6.
Nếu HS làm cách khác và viết đầy đủ phản ứng thì cũng cho điểm tối đa.
Câu 3. 2,0 điểm
Tính chất hóa học của etilen: Phản ứng cộng, phản ứng trùng hợp, phản ứng oxi hóa
C2H4 + H2→ C2H6
CH2=CH2→ (-CH2-CH2-)n
3CH2=CH2 + 2KMnO4 + 4H2O → 3CH2OH-CH2OH + 2MnO2 + 2KOH
Nêu tính chất hóa học đúng được 0,5 điểm
Mỗi tính chất viết PTHH minh họa đúng được 0,5 điểm
Câu 4. 2,0 điểm
a. PTHH
C2H4 + Br2→ C2H4Br2
C2H2 + 2Br2→ C2H2Br4
b. Đặt số mol mỗi khí lần lượt là x và y
Ta có: x + y = 6,72/22,4 = 0,3
Và: x + 2y = 64/160 = 0,4
Giải ra: x = 0,2, y = 0,1
% số mol C2H4 = 66,67%, % số mol C2H2 = 33,33%











