Bộ đề thi học kì 2 môn Hóa học lớp 10 trường THPT Đa Phúc, Hà Nội năm học 2016 - 2017 có đáp án kèm theo là tài liệu tham khảo được Tìm Đáp Án sưu tầm và giới thiệu tới các bạn học sinh để củng cố và nâng cao kiến thức ôn thi học kì II môn Hóa lớp 10, ôn thi cuối năm. Chúc các bạn học tốt và đạt được kết quả tốt trong các kì thi sắp tới.
Đề thi cuối học kì 2 môn Hóa học lớp 10
- Đề thi cuối học kỳ 2 môn hóa lớp 10 THPT Đa Phúc - mã đề H111
- Đề thi cuối học kỳ 2 môn hóa lớp 10 THPT Đa Phúc - mã đề H112
- Đề thi cuối học kỳ 2 môn hóa lớp 10 THPT Đa Phúc - mã đề H113
- Đề thi cuối học kỳ 2 môn hóa lớp 10 THPT Đa Phúc - mã đề H114
- Đề thi cuối học kỳ 2 môn hóa lớp 10 THPT Đa Phúc - mã đề H115
- Đề thi cuối học kỳ 2 môn hóa lớp 10 THPT Đa Phúc - mã đề H116
- Đáp án đề thi cuối học kì 2 môn Hóa học lớp 10
|
TRƯỜNG THPT ĐA PHÚC NĂM HỌC 2016 - 2017 |
ĐỀ KIỂM TRA HỌC KỲ 2 Môn: Hoá học - Lớp 10 Thời gian: 45 phút |
Đề thi cuối học kỳ 2 môn hóa lớp 10 THPT Đa Phúc - mã đề H111
I–Trắc nghiệm (5,0 điểm)
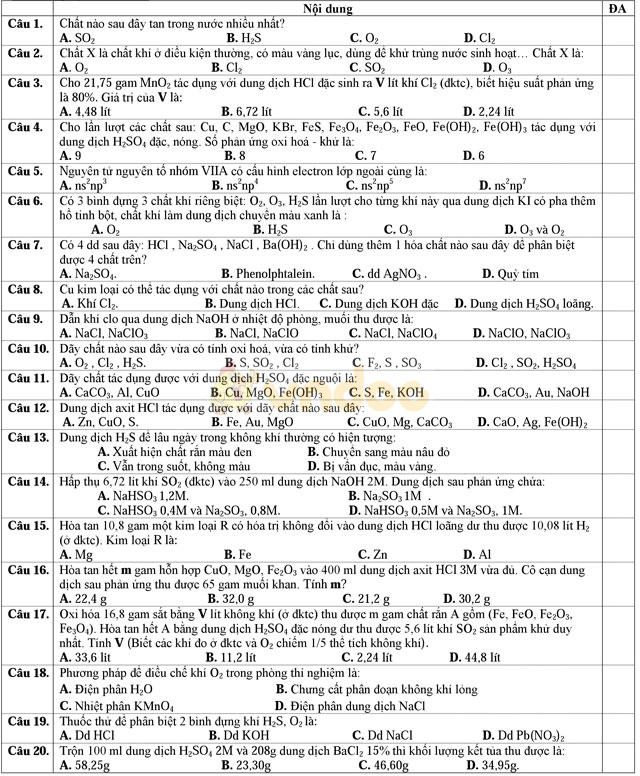
II–Tự luận (5,0 điểm)
Bài 1. (2,5 điểm)
Hoàn thành các phương trình hóa học sau (ghi rõ điều kiện phản ứng nếu có).
a. Fe + Cl2 .........................................................................................................
b. Ba(NO3)2 + MgSO4 .................................................................................................
c. HCl + Mg(OH)2 ....................................................................................................
d. P + H2SO4 đặc, nóng .............................................................................................
e. Al + H2SO4 đặc, nóng SO2 + H2S + ..... ............................................................
(biết tỉ lệ mol SO2 và H2S là 1 : 3)
Bài 2. (2,5 điểm)
Hòa tan 22,8 gam hỗn hợp X gồm Mg và Fe vào dung dịch H2SO4 98% (đặc, nóng, dư). Sau khi phản ứng xảy ra hoàn toàn, thấy thoát ra 15,68 lít khí SO2 là sản phẩm khử duy nhất (ở đktc) và thu được dung dịch Y.
a. Tính thành phần % khối lượng mỗi kim loại trong X. (1,5 điểm)
b. Để trung hòa hết lượng axit dư trong dung dịch Y cần dùng 400 ml dung dịch NaOH 3M. Tính khối lượng dung dịch H2SO4 98% ban đầu. (0,5 điểm)
c. Lượng axit trên hòa tan vừa hết m gam hỗn hợp FeS2, Cu2S (tỉ lệ mol tương ứng 2:1) thu được sản phẩm khử duy nhất là SO2. Tính khối lượng muối thu được sau phản ứng. (0,5 điểm)
(Cho: Al = 27; Fe = 56; Mg = 24; Zn = 65; Ba = 137; O = 16; H = 1; Cu = 64; Na = 23; O =16; Mn = 55; S = 32; Cl = 35,5)
(Học sinh không được sử dụng Bảng tuần hoàn)
Đề thi cuối học kỳ 2 môn hóa lớp 10 THPT Đa Phúc - mã đề H112
|
| Nội dung | ĐA |
| Câu 1. | Thuốc thử để phân biệt 2 bình đựng khí H2S, O2 là: A. Dd HCl B. Dd KOH C. Dd NaCl D. Dd Pb(NO3)2 |
|
| Câu 2. | Phương pháp để điều chế khí O2 trong phòng thí nghiệm là: A. Điện phân H2O B. Chưng cất phân đoạn không khí lỏng C. Nhiệt phân KMnO4 D. Điện phân dung dịch NaCl |
|
| Câu 3. | Hòa tan hết m gam hỗn hợp CuO, MgO, Fe2O3 vào 400 ml dung dịch axit HCl 3M vừa đủ. Cô cạn dung dịch sau phản ứng thu được 65 gam muối khan. Tính m? A. 22,4 g B. 32,0 g C. 21,2 g D. 30,2 g |
|
| Câu 4. | Dung dịch H2S để lâu ngày trong không khí thường có hiện tượng: A. Xuất hiện chất rắn màu đen B. Chuyển sang màu nâu đỏ C. Vẫn trong suốt, không màu D. Bị vẩn đục, màu vàng. |
|
| Câu 5. | Dung dịch axit HCl tác dụng được với dãy chất nào sau đây: A. Zn, CuO, S. B. Fe, Au, MgO C. CuO, Mg, CaCO3 D. CaO, Ag, Fe(OH)2 |
|
| Câu 6. | Dãy chất tác dụng được với dung dịch H2SO4 đặc nguội là: A. CaCO3, Al, CuO B. Cu, MgO, Fe(OH)3 C. S, Fe, KOH D. CaCO3, Au, NaOH |
|
| Câu 7. | Dãy chất nào sau đây vừa có tính oxi hoá, vừa có tính khử? A. O2 , Cl2 , H2S. B. S, SO2 , Cl2 C. F2, S , SO3 D. Cl2 , SO2, H2SO4 |
|
| Câu 8. | Dẫn khí clo qua dung dịch NaOH ở nhiệt độ phòng, muối thu được là: A. NaCl, NaClO3 B. NaCl, NaClO C. NaCl, NaClO4 D. NaClO, NaClO3 |
|
| Câu 9. | Cu kim loại có thể tác dụng với chất nào trong các chất sau? A. Khí Cl2. B. Dung dịch HCl. C. Dung dịch KOH đặc D. Dung dịch H2SO4 loãng. |
|
| Câu 10. | Có 4 dd sau đây: HCl , Na2SO4 , NaCl , Ba(OH)2 . Chỉ dùng thêm 1 hóa chất nào sau đây để phân biệt được 4 chất trên? A. Na2SO4. B. Phenolphtalein. C. dd AgNO3 . D. Quỳ tím |
|
| Câu 11. | Có 3 bình đựng 3 chất khí riêng biệt: O2, O3, H2S lần lượt cho từng khí này qua dung dịch KI có pha thêm hồ tinh bột, chất khí làm dung dịch chuyển màu xanh là : A. O2 B. H2S C. O3 D. O3 và O2 |
|
| Câu 12. | Nguyên tử nguyên tố nhóm VIIA có cấu hình electron lớp ngoài cùng là: A. ns2np3 B. ns2np4 C. ns2np5 D. ns2np7 |
|
| Câu 13. | Cho lần lượt các chất sau: Cu, C, MgO, KBr, FeS, Fe3O4, Fe2O3, FeO, Fe(OH)2, Fe(OH)3 tác dụng với dung dịch H2SO4 đặc, nóng. Số phản ứng oxi hoá - khử là: A. 9 B. 8 C. 7 D. 6 |
|
| Câu 14. | Cho 21,75 gam MnO2 tác dụng với dung dịch HCl đặc sinh ra V lít khí Cl2 (đktc), biết hiệu suất phản ứng là 80%. Giá trị của V là: A. 4,48 lít B. 6,72 lít C. 5,6 lít D. 2,24 lít |
|
| Câu 15. | Chất X là chất khí ở điều kiện thường, có màu vàng lục, dùng để khử trùng nước sinh hoạt… Chất X là: A. O2 B. Cl2 C. SO2 D. O3 |
|
| Câu 16. | Chất nào sau đây tan trong nước nhiều nhất? A. SO2 B. H2S C. O2 D. Cl2 |
|
| Câu 17. | Hấp thụ 6,72 lít khí SO2 (đktc) vào 250 ml dung dịch NaOH 2M. Dung dịch sau phản ứng chứa: A. NaHSO3 1,2M. B. Na2SO3 1M . C. NaHSO3 0,4M và Na2SO3, 0,8M. D. NaHSO3 0,5M và Na2SO3, 1M. |
|
| Câu 18. | Trộn 100 ml dung dịch H2SO4 2M và 208g dung dịch BaCl2 15% thì khối lượng kết tủa thu được là: A. 58,25g B. 23,30g C. 46,60g D. 34,95g. |
|
| Câu 19. | Hòa tan 10,8 gam một kim loại R có hóa trị không đổi vào dung dịch HCl loãng dư thu được 10,08 lít H2 (ở đktc). Kim loại R là: A. Mg B. Fe C. Zn D. Al |
|
| Câu 20. | Oxi hóa 16,8 gam sắt bằng V lít không khí (ở đktc) thu được m gam chất rắn A gồm (Fe, FeO, Fe2O3, Fe3O4). Hòa tan hết A bằng dung dịch H2SO4 đặc nóng dư thu được 5,6 lít khí SO2 sản phẩm khử duy nhất. Tính V (Biết các khí đo ở đktc và O2 chiếm 1/5 thể tích không khí). A. 33,6 lit B. 11,2 lít C. 2,24 lít D. 44,8 lít |
II- Tự luận: (5,0 điểm)
Bài 1. (2,5 điểm)
Hoàn thành các phương trình hóa học sau (ghi rõ điều kiện phản ứng nếu có).
- Al + Cl2 ………………………………………………………………………………………………
- Cu(OH)2+ HCl ………………………………………………………………………………………
- C + H2SO4đặc, nóng ……………………………………………………………………………….
- Ba(OH)2+ Na2SO4 ………………………………………………………………………………..
- Mg + H2SO4đặc, nóng SO2 + H2S + .............................................................................................
(biết tỉ lệ mol SO2 và H2S là 2 : 3)
Bài 2: (2,5 điểm)
Hòa tan 15 gam hỗn hợp X gồm Al và Cu vào dung dịch H2SO4 98% (đặc, nóng, dư). Sau khi phản ứng xảy ra hoàn toàn, thấy thoát ra 10,08 lít khí SO2 là sản phẩm khử duy nhất (ở đktc) và thu được dung dịch Y.
1. Tính thành phần % khối lượng mỗi kim loại trong X. (1,5 điểm)
2. Để trung hòa hết lượng axit dư trong dung dịch Y cần dùng 500 ml dung dịch NaOH 3M. Tính khối lượng dung dịch H2SO498% ban đầu. (0,5 điểm)
3. Lượng axit trên hòa tan vừa hết m gam hỗn hợp FeS2, Cu2S (tỉ lệ mol tương ứng 1:3) thu được sản phẩm khử duy nhất là SO2. Tính khối lượng muối thu được sau phản ứng. (0,5 điểm)
(Cho: Al=27; Fe =56; Mg=24; Zn=65; Ba=137; O=16; H =1; Cu=64; Na=23; O=16; Mn=55; S=32; Cl=35,5)
(Học sinh không được sử dụng Bảng tuần hoàn)
Đề thi cuối học kỳ 2 môn hóa lớp 10 THPT Đa Phúc - mã đề H113
|
| Nội dung | ĐA |
| Câu 1. | Cu kim loại có thể tác dụng với chất nào trong các chất sau? A. Khí Cl2. B. Dung dịch HCl. C. Dung dịch KOH đặc D. Dung dịch H2SO4 loãng. |
|
| Câu 2. | Dung dịch axit HCl tác dụng được với dãy chất nào sau đây: A. Zn, CuO, S. B. Fe, Au, MgO C. CuO, Mg, CaCO3 D. CaO, Ag, Fe(OH)2 |
|
| Câu 3. | Phương pháp để điều chế khí O2 trong phòng thí nghiệm là: A. Điện phân H2O B. Chưng cất phân đoạn không khí lỏng C. Nhiệt phân KMnO4 D. Điện phân dung dịch NaCl |
|
| Câu 4. | Có 3 bình đựng 3 chất khí riêng biệt: O2, O3, H2S lần lượt cho từng khí này qua dung dịch KI có pha thêm hồ tinh bột, chất khí làm dung dịch chuyển màu xanh là : A. O2 B. H2S C. O3 D. O3 và O2 |
|
| Câu 5. | Hấp thụ 6,72 lít khí SO2 (đktc) vào 250 ml dung dịch NaOH 2M. Dung dịch sau phản ứng chứa: A. NaHSO3 1,2M. B. Na2SO3 1M . C. NaHSO3 0,4M và Na2SO3, 0,8M. D. NaHSO3 0,5M và Na2SO3, 1M. |
|
| Câu 6. | Chất nào sau đây tan trong nước nhiều nhất? A. SO2 B. H2S C. O2 D. Cl2 |
|
| Câu 7. | Dung dịch H2S để lâu ngày trong không khí thường có hiện tượng: A. Xuất hiện chất rắn màu đen B. Chuyển sang màu nâu đỏ C. Vẫn trong suốt, không màu D. Bị vẩn đục, màu vàng. |
|
| Câu 8. | Thuốc thử để phân biệt 2 bình đựng khí H2S, O2 là: A. Dd HCl B. Dd KOH C. Dd NaCl D. Dd Pb(NO3)2 |
|
| Câu 9. | Nguyên tử nguyên tố nhóm VIIA có cấu hình electron lớp ngoài cùng là: A. ns2np3 B. ns2np4 C. ns2np5 D. ns2np7 |
|
| Câu 10. | Chất X là chất khí ở điều kiện thường, có màu vàng lục, dùng để khử trùng nước sinh hoạt… Chất X là: A. O2 B. Cl2 C. SO2 D. O3 |
|
| Câu 11. | Cho 21,75 gam MnO2 tác dụng với dung dịch HCl đặc sinh ra V lít khí Cl2 (đktc), biết hiệu suất phản ứng là 80%. Giá trị của V là: A. 4,48 lít B. 6,72 lít C. 5,6 lít D. 2,24 lít |
|
| Câu 12. | Dãy chất nào sau đây vừa có tính oxi hoá, vừa có tính khử? A. O2 , Cl2 , H2S. B. S, SO2 , Cl2 C. F2, S , SO3 D. Cl2 , SO2, H2SO4 |
|
| Câu 13. | Oxi hóa 16,8 gam sắt bằng V lít không khí (ở đktc) thu được m gam chất rắn A gồm (Fe, FeO, Fe2O3, Fe3O4). Hòa tan hết A bằng dung dịch H2SO4 đặc nóng dư thu được 5,6 lít khí SO2 sản phẩm khử duy nhất. Tính V (Biết các khí đo ở đktc và O2 chiếm 1/5 thể tích không khí). A. 33,6 lit B. 11,2 lít C. 2,24 lít D. 44,8 lít |
|
| Câu 14. | Dãy chất tác dụng được với dung dịch H2SO4 đặc nguội là: A. CaCO3, Al, CuO B. Cu, MgO, Fe(OH)3 C. S, Fe, KOH D. CaCO3, Au, NaOH |
|
| Câu 15. | Trộn 100 ml dung dịch H2SO4 2M và 208g dung dịch BaCl2 15% thì khối lượng kết tủa thu được là: A. 58,25g B. 23,30g C. 46,60g D. 34,95g. |
|
| Câu 16. | Cho lần lượt các chất sau: Cu, C, MgO, KBr, FeS, Fe3O4, Fe2O3, FeO, Fe(OH)2, Fe(OH)3 tác dụng với dung dịch H2SO4 đặc, nóng. Số phản ứng oxi hoá - khử là: A. 9 B. 8 C. 7 D. 6 |
|
| Câu 17. | Dẫn khí clo qua dung dịch NaOH ở nhiệt độ phòng, muối thu được là: A. NaCl, NaClO3 B. NaCl, NaClO C. NaCl, NaClO4 D. NaClO, NaClO3 |
|
| Câu 18. | Hòa tan 10,8 gam một kim loại R có hóa trị không đổi vào dung dịch HCl loãng dư thu được 10,08 lít H2 (ở đktc). Kim loại R là: A. Mg B. Fe C. Zn D. Al |
|
| Câu 19. | Hòa tan hết m gam hỗn hợp CuO, MgO, Fe2O3 vào 400 ml dung dịch axit HCl 3M vừa đủ. Cô cạn dung dịch sau phản ứng thu được 65 gam muối khan. Tính m? A. 22,4 g B. 32,0 g C. 21,2 g D. 30,2 g |
|
| Câu 20. | Có 4 dd sau đây: HCl , Na2SO4 , NaCl , Ba(OH)2 . Chỉ dùng thêm 1 hóa chất nào sau đây để phân biệt được 4 chất trên? A. Na2SO4. B. Phenolphtalein. C. dd AgNO3 . D. Quỳ tím |
II–Tự luận (5,0 điểm)
Bài 1. (2,5 điểm)
Hoàn thành các phương trình hóa học sau (ghi rõ điều kiện phản ứng nếu có).
- Fe + Cl2 ……………………………………………………………………………………………
- Ba(NO3)2+ MgSO4 …………………………………………………………………………………….
- HCl + Mg(OH)2……………………………………………………………………………………….
- P + H2SO4đặc, nóng …………………………………………………………………………………
- Al + H2SO4đặc, nóng SO2 + H2S + ..... ……………………………………………………
(biết tỉ lệ mol SO2 và H2S là 1 : 3)
Bài 2. (2,5 điểm)
Hòa tan 22,8 gam hỗn hợp X gồm Mg và Fe vào dung dịch H2SO4 98% (đặc, nóng, dư). Sau khi phản ứng xảy ra hoàn toàn, thấy thoát ra 15,68 lít khí SO2 là sản phẩm khử duy nhất (ở đktc) và thu được dung dịch Y.
- Tính thành phần % khối lượng mỗi kim loại trong X. (1,5 điểm)
- Để trung hòa hết lượng axit dư trong dung dịch Y cần dùng 400 ml dung dịch NaOH 3M. Tính khối lượng dung dịch H2SO498% ban đầu. (0,5 điểm)
- Lượng axit trên hòa tan vừa hết m gam hỗn hợp FeS2, Cu2S (tỉ lệ mol tương ứng 2:1) thu được sản phẩm khử duy nhất là SO2. Tính khối lượng muối thu được sau phản ứng. (0,5 điểm)
(Cho: Al=27; Fe =56; Mg=24; Zn=65; Ba=137; O=16; H =1; Cu=64; Na=23; O=16; Mn=55; S=32; Cl=35,5)
(Học sinh không được sử dụng Bảng tuần hoàn)
Đề thi cuối học kỳ 2 môn hóa lớp 10 THPT Đa Phúc - mã đề H114
|
| Nội dung | ĐA |
| Câu 1. | Phương pháp để điều chế khí O2 trong phòng thí nghiệm là: A. Điện phân H2O B. Chưng cất phân đoạn không khí lỏng C. Nhiệt phân KMnO4 D. Điện phân dung dịch NaCl |
|
| Câu 2. | Hòa tan hết m gam hỗn hợp CuO, MgO, Fe2O3 vào 400 ml dung dịch axit HCl 3M vừa đủ. Cô cạn dung dịch sau phản ứng thu được 65 gam muối khan. Tính m? A. 22,4 g B. 32,0 g C. 21,2 g D. 30,2 g |
|
| Câu 3. | Dãy chất tác dụng được với dung dịch H2SO4 đặc nguội là: A. CaCO3, Al, CuO B. Cu, MgO, Fe(OH)3 C. S, Fe, KOH D. CaCO3, Au, NaOH |
|
| Câu 4. | Có 3 bình đựng 3 chất khí riêng biệt: O2, O3, H2S lần lượt cho từng khí này qua dung dịch KI có pha thêm hồ tinh bột, chất khí làm dung dịch chuyển màu xanh là : A. O2 B. H2S C. O3 D. O3 và O2 |
|
| Câu 5. | Nguyên tử nguyên tố nhóm VIIA có cấu hình electron lớp ngoài cùng là: A. ns2np3 B. ns2np4 C. ns2np5 D. ns2np7 |
|
| Câu 6. | Dẫn khí clo qua dung dịch NaOH ở nhiệt độ phòng, muối thu được là: A. NaCl, NaClO3 B. NaCl, NaClO C. NaCl, NaClO4 D. NaClO, NaClO3 |
|
| Câu 7. | Hòa tan 10,8 gam một kim loại R có hóa trị không đổi vào dung dịch HCl loãng dư thu được 10,08 lít H2 (ở đktc). Kim loại R là: A. Mg B. Fe C. Zn D. Al |
|
| Câu 8. | Hấp thụ 6,72 lít khí SO2 (đktc) vào 250 ml dung dịch NaOH 2M. Dung dịch sau phản ứng chứa: A. NaHSO3 1,2M. B. Na2SO3 1M . C. NaHSO3 0,4M và Na2SO3, 0,8M. D. NaHSO3 0,5M và Na2SO3, 1M. |
|
| Câu 9. | Cu kim loại có thể tác dụng với chất nào trong các chất sau? A. Khí Cl2. B. Dung dịch HCl. C. Dung dịch KOH đặc D. Dung dịch H2SO4 loãng. |
|
| Câu 10. | Dung dịch axit HCl tác dụng được với dãy chất nào sau đây: A. Zn, CuO, S. B. Fe, Au, MgO C. CuO, Mg, CaCO3 D. CaO, Ag, Fe(OH)2 |
|
| Câu 11. | Chất X là chất khí ở điều kiện thường, có màu vàng lục, dùng để khử trùng nước sinh hoạt… Chất X là: A. O2 B. Cl2 C. SO2 D. O3 |
|
| Câu 12. | Oxi hóa 16,8 gam sắt bằng V lít không khí (ở đktc) thu được m gam chất rắn A gồm (Fe, FeO, Fe2O3, Fe3O4). Hòa tan hết A bằng dung dịch H2SO4 đặc nóng dư thu được 5,6 lít khí SO2 sản phẩm khử duy nhất. Tính V (Biết các khí đo ở đktc và O2 chiếm 1/5 thể tích không khí). A. 33,6 lit B. 11,2 lít C. 2,24 lít D. 44,8 lít |
|
| Câu 13. | Có 4 dd sau đây: HCl , Na2SO4 , NaCl , Ba(OH)2 . Chỉ dùng thêm 1 hóa chất nào sau đây để phân biệt được 4 chất trên? A. Na2SO4. B. Phenolphtalein. C. dd AgNO3 . D. Quỳ tím |
|
| Câu 14. | Dãy chất nào sau đây vừa có tính oxi hoá, vừa có tính khử? A. O2 , Cl2 , H2S. B. S, SO2 , Cl2 C. F2, S , SO3 D. Cl2 , SO2, H2SO4 |
|
| Câu 15. | Cho lần lượt các chất sau: Cu, C, MgO, KBr, FeS, Fe3O4, Fe2O3, FeO, Fe(OH)2, Fe(OH)3 tác dụng với dung dịch H2SO4 đặc, nóng. Số phản ứng oxi hoá - khử là: A. 9 B. 8 C. 7 D. 6 |
|
| Câu 16. | Thuốc thử để phân biệt 2 bình đựng khí H2S, O2 là: A. Dd HCl B. Dd KOH C. Dd NaCl D. Dd Pb(NO3)2 |
|
| Câu 17. | Cho 21,75 gam MnO2 tác dụng với dung dịch HCl đặc sinh ra V lít khí Cl2 (đktc), biết hiệu suất phản ứng là 80%. Giá trị của V là: A. 4,48 lít B. 6,72 lít C. 5,6 lít D. 2,24 lít |
|
| Câu 18. | Dung dịch H2S để lâu ngày trong không khí thường có hiện tượng: A. Xuất hiện chất rắn màu đen B. Chuyển sang màu nâu đỏ C. Vẫn trong suốt, không màu D. Bị vẩn đục, màu vàng. |
|
| Câu 19. | Chất nào sau đây tan trong nước nhiều nhất? A. SO2 B. H2S C. O2 D. Cl2 |
|
| Câu 20. | Trộn 100 ml dung dịch H2SO4 2M và 208g dung dịch BaCl2 15% thì khối lượng kết tủa thu được là: A. 58,25g B. 23,30g C. 46,60g D. 34,95g. |
II- Tự luận: (5,0 điểm)
Bài 1. (2,5 điểm)
Hoàn thành các phương trình hóa học sau (ghi rõ điều kiện phản ứng nếu có).
- Al + Cl2 ………………………………………………………………………………………………
- Cu(OH)2+ HCl ………………………………………………………………………………………
- C + H2SO4đặc, nóng ……………………………………………………………………………….
- Ba(OH)2+ Na2SO4 ………………………………………………………………………………..
- e.Mg + H2SO4đặc, nóng SO2 + H2S + .............................................................................................
(biết tỉ lệ mol SO2 và H2S là 2 : 3)
Bài 2: (2,5 điểm)
Hòa tan 15 gam hỗn hợp X gồm Al và Cu vào dung dịch H2SO4 98% (đặc, nóng, dư). Sau khi phản ứng xảy ra hoàn toàn, thấy thoát ra 10,08 lít khí SO2 là sản phẩm khử duy nhất (ở đktc) và thu được dung dịch Y.
- Tính thành phần % khối lượng mỗi kim loại trong X. (1,5 điểm)
- Để trung hòa hết lượng axit dư trong dung dịch Y cần dùng 500 ml dung dịch NaOH 3M. Tính khối lượng dung dịch H2SO498% ban đầu. (0,5 điểm)
- Lượng axit trên hòa tan vừa hết m gam hỗn hợp FeS2, Cu2S (tỉ lệ mol tương ứng 1:3) thu được sản phẩm khử duy nhất là SO2. Tính khối lượng muối thu được sau phản ứng. (0,5 điểm.
(Cho: Al=27; Fe =56; Mg=24; Zn=65; Ba=137; O=16; H =1; Cu=64; Na=23; O=16; Mn=55; S=32; Cl=35,5)
(Học sinh không được sử dụng Bảng tuần hoàn)
Đề thi cuối học kỳ 2 môn hóa lớp 10 THPT Đa Phúc - mã đề H115
|
| Nội dung | ĐA |
| Câu 1. | Dãy chất nào sau đây vừa có tính oxi hoá, vừa có tính khử? A. O2 , Cl2 , H2S. B. S, SO2 , Cl2 C. F2, S , SO3 D. Cl2 , SO2, H2SO4 |
|
| Câu 2. | Nguyên tử nguyên tố nhóm VIIA có cấu hình electron lớp ngoài cùng là: A. ns2np3 B. ns2np4 C. ns2np5 D. ns2np7 |
|
| Câu 3. | Dung dịch H2S để lâu ngày trong không khí thường có hiện tượng: A. Xuất hiện chất rắn màu đen B. Chuyển sang màu nâu đỏ C. Vẫn trong suốt, không màu D. Bị vẩn đục, màu vàng. |
|
| Câu 4. | Có 4 dd sau đây: HCl , Na2SO4 , NaCl , Ba(OH)2 . Chỉ dùng thêm 1 hóa chất nào sau đây để phân biệt được 4 chất trên? A. Na2SO4. B. Phenolphtalein. C. dd AgNO3 . D. Quỳ tím |
|
| Câu 5. | Dẫn khí clo qua dung dịch NaOH ở nhiệt độ phòng, muối thu được là: A. NaCl, NaClO3 B. NaCl, NaClO C. NaCl, NaClO4 D. NaClO, NaClO3 |
|
| Câu 6. | Chất nào sau đây tan trong nước nhiều nhất? A. SO2 B. H2S C. O2 D. Cl2 |
|
| Câu 7. | Dung dịch axit HCl tác dụng được với dãy chất nào sau đây: A. Zn, CuO, S. B. Fe, Au, MgO C. CuO, Mg, CaCO3 D. CaO, Ag, Fe(OH)2 |
|
| Câu 8. | Oxi hóa 16,8 gam sắt bằng V lít không khí (ở đktc) thu được m gam chất rắn A gồm (Fe, FeO, Fe2O3, Fe3O4). Hòa tan hết A bằng dung dịch H2SO4 đặc nóng dư thu được 5,6 lít khí SO2 sản phẩm khử duy nhất. Tính V (Biết các khí đo ở đktc và O2 chiếm 1/5 thể tích không khí). A. 33,6 lit B. 11,2 lít C. 2,24 lít D. 44,8 lít |
|
| Câu 9. | Chất X là chất khí ở điều kiện thường, có màu vàng lục, dùng để khử trùng nước sinh hoạt… Chất X là: A. O2 B. Cl2 C. SO2 D. O3 |
|
| Câu 10. | Cu kim loại có thể tác dụng với chất nào trong các chất sau? A. Khí Cl2. B. Dung dịch HCl. C. Dung dịch KOH đặc D. Dung dịch H2SO4 loãng. |
|
| Câu 11. | Cho lần lượt các chất sau: Cu, C, MgO, KBr, FeS, Fe3O4, Fe2O3, FeO, Fe(OH)2, Fe(OH)3 tác dụng với dung dịch H2SO4 đặc, nóng. Số phản ứng oxi hoá - khử là: A. 9 B. 8 C. 7 D. 6 |
|
| Câu 12. | Hòa tan hết m gam hỗn hợp CuO, MgO, Fe2O3 vào 400 ml dung dịch axit HCl 3M vừa đủ. Cô cạn dung dịch sau phản ứng thu được 65 gam muối khan. Tính m? A. 22,4 g B. 32,0 g C. 21,2 g D. 30,2 g |
|
| Câu 13. | Thuốc thử để phân biệt 2 bình đựng khí H2S, O2 là: A. Dd HCl B. Dd KOH C. Dd NaCl D. Dd Pb(NO3)2 |
|
| Câu 14. | Có 3 bình đựng 3 chất khí riêng biệt: O2, O3, H2S lần lượt cho từng khí này qua dung dịch KI có pha thêm hồ tinh bột, chất khí làm dung dịch chuyển màu xanh là : A. O2 B. H2S C. O3 D. O3 và O2 |
|
| Câu 15. | Hấp thụ 6,72 lít khí SO2 (đktc) vào 250 ml dung dịch NaOH 2M. Dung dịch sau phản ứng chứa: A. NaHSO3 1,2M. B. Na2SO3 1M . C. NaHSO3 0,4M và Na2SO3, 0,8M. D. NaHSO3 0,5M và Na2SO3, 1M. |
|
| Câu 16. | Phương pháp để điều chế khí O2 trong phòng thí nghiệm là: A. Điện phân H2O B. Chưng cất phân đoạn không khí lỏng C. Nhiệt phân KMnO4 D. Điện phân dung dịch NaCl |
|
| Câu 17. | Cho 21,75 gam MnO2 tác dụng với dung dịch HCl đặc sinh ra V lít khí Cl2 (đktc), biết hiệu suất phản ứng là 80%. Giá trị của V là: A. 4,48 lít B. 6,72 lít C. 5,6 lít D. 2,24 lít |
|
| Câu 18. | Dãy chất tác dụng được với dung dịch H2SO4 đặc nguội là: A. CaCO3, Al, CuO B. Cu, MgO, Fe(OH)3 C. S, Fe, KOH D. CaCO3, Au, NaOH |
|
| Câu 19. | Hòa tan 10,8 gam một kim loại R có hóa trị không đổi vào dung dịch HCl loãng dư thu được 10,08 lít H2 (ở đktc). Kim loại R là: A. Mg B. Fe C. Zn D. Al |
|
| Câu 20. | Trộn 100 ml dung dịch H2SO4 2M và 208g dung dịch BaCl2 15% thì khối lượng kết tủa thu được là: A. 58,25g B. 23,30g C. 46,60g D. 34,95g. |
II–Tự luận (5,0 điểm)
Bài 1. (2,5 điểm)
Hoàn thành các phương trình hóa học sau (ghi rõ điều kiện phản ứng nếu có).
- Fe + Cl2 ……………………………………………………………………………………………
- Ba(NO3)2+ MgSO4 …………………………………………………………………………………….
- HCl + Mg(OH)2……………………………………………………………………………………….
- P + H2SO4đặc, nóng …………………………………………………………………………………
- Al + H2SO4đặc, nóng SO2 + H2S + ..... ……………………………………………………
(biết tỉ lệ mol SO2 và H2S là 1 : 3)
Bài 2. (2,5 điểm)
Hòa tan 22,8 gam hỗn hợp X gồm Mg và Fe vào dung dịch H2SO4 98% (đặc, nóng, dư). Sau khi phản ứng xảy ra hoàn toàn, thấy thoát ra 15,68 lít khí SO2 là sản phẩm khử duy nhất (ở đktc) và thu được dung dịch Y.
- Tính thành phần % khối lượng mỗi kim loại trong X. (1,5 điểm)
- Để trung hòa hết lượng axit dư trong dung dịch Y cần dùng 400 ml dung dịch NaOH 3M. Tính khối lượng dung dịch H2SO498% ban đầu. (0,5 điểm)
- Lượng axit trên hòa tan vừa hết m gam hỗn hợp FeS2, Cu2S (tỉ lệ mol tương ứng 2:1) thu được sản phẩm khử duy nhất là SO2. Tính khối lượng muối thu được sau phản ứng. (0,5 điểm)
(Cho: Al=27; Fe =56; Mg=24; Zn=65; Ba=137; O=16; H =1; Cu=64; Na=23; O=16; Mn=55; S=32; Cl=35,5)
(Học sinh không được sử dụng Bảng tuần hoàn)
Đề thi cuối học kỳ 2 môn hóa lớp 10 THPT Đa Phúc - mã đề H116
|
| Nội dung | ĐA |
| Câu 1. | Dung dịch axit HCl tác dụng được với dãy chất nào sau đây: A. Zn, CuO, S. B. Fe, Au, MgO C. CuO, Mg, CaCO3 D. CaO, Ag, Fe(OH)2 |
|
| Câu 2. | Dẫn khí clo qua dung dịch NaOH ở nhiệt độ phòng, muối thu được là: A. NaCl, NaClO3 B. NaCl, NaClO C. NaCl, NaClO4 D. NaClO, NaClO3 |
|
| Câu 3. | Cu kim loại có thể tác dụng với chất nào trong các chất sau? A. Khí Cl2. B. Dung dịch HCl. C. Dung dịch KOH đặc D. Dung dịch H2SO4 loãng. |
|
| Câu 4. | Cho lần lượt các chất sau: Cu, C, MgO, KBr, FeS, Fe3O4, Fe2O3, FeO, Fe(OH)2, Fe(OH)3 tác dụng với dung dịch H2SO4 đặc, nóng. Số phản ứng oxi hoá - khử là: A. 9 B. 8 C. 7 D. 6 |
|
| Câu 5. | Nguyên tử nguyên tố nhóm VIIA có cấu hình electron lớp ngoài cùng là: A. ns2np3 B. ns2np4 C. ns2np5 D. ns2np7 |
|
| Câu 6. | Chất nào sau đây tan trong nước nhiều nhất? A. SO2 B. H2S C. O2 D. Cl2 |
|
| Câu 7. | Thuốc thử để phân biệt 2 bình đựng khí H2S, O2 là: A. Dd HCl B. Dd KOH C. Dd NaCl D. Dd Pb(NO3)2 |
|
| Câu 8. | Dung dịch H2S để lâu ngày trong không khí thường có hiện tượng: A. Xuất hiện chất rắn màu đen B. Chuyển sang màu nâu đỏ C. Vẫn trong suốt, không màu D. Bị vẩn đục, màu vàng. |
|
| Câu 9. | Phương pháp để điều chế khí O2 trong phòng thí nghiệm là: A. Điện phân H2O B. Chưng cất phân đoạn không khí lỏng C. Nhiệt phân KMnO4 D. Điện phân dung dịch NaCl |
|
| Câu 10. | Có 4 dd sau đây: HCl , Na2SO4 , NaCl , Ba(OH)2 . Chỉ dùng thêm 1 hóa chất nào sau đây để phân biệt được 4 chất trên? A. Na2SO4. B. Phenolphtalein. C. dd AgNO3 . D. Quỳ tím |
|
| Câu 11. | Hấp thụ 6,72 lít khí SO2 (đktc) vào 250 ml dung dịch NaOH 2M. Dung dịch sau phản ứng chứa: A. NaHSO3 1,2M. B. Na2SO3 1M . C. NaHSO3 0,4M và Na2SO3, 0,8M. D. NaHSO3 0,5M và Na2SO3, 1M. |
|
| Câu 12. | Chất X là chất khí ở điều kiện thường, có màu vàng lục, dùng để khử trùng nước sinh hoạt… Chất X là: A. O2 B. Cl2 C. SO2 D. O3 |
|
| Câu 13. | Hòa tan 10,8 gam một kim loại R có hóa trị không đổi vào dung dịch HCl loãng dư thu được 10,08 lít H2 (ở đktc). Kim loại R là: A. Mg B. Fe C. Zn D. Al |
|
| Câu 14. | Trộn 100 ml dung dịch H2SO4 2M và 208g dung dịch BaCl2 15% thì khối lượng kết tủa thu được là: A. 58,25g B. 23,30g C. 46,60g D. 34,95g. |
|
| Câu 15. | Hòa tan hết m gam hỗn hợp CuO, MgO, Fe2O3 vào 400 ml dung dịch axit HCl 3M vừa đủ. Cô cạn dung dịch sau phản ứng thu được 65 gam muối khan. Tính m? A. 22,4 g B. 32,0 g C. 21,2 g D. 30,2 g |
|
| Câu 16. | Oxi hóa 16,8 gam sắt bằng V lít không khí (ở đktc) thu được m gam chất rắn A gồm (Fe, FeO, Fe2O3, Fe3O4). Hòa tan hết A bằng dung dịch H2SO4 đặc nóng dư thu được 5,6 lít khí SO2 sản phẩm khử duy nhất. Tính V (Biết các khí đo ở đktc và O2 chiếm 1/5 thể tích không khí). A. 33,6 lit B. 11,2 lít C. 2,24 lít D. 44,8 lít |
|
| Câu 17. | Dãy chất nào sau đây vừa có tính oxi hoá, vừa có tính khử? A. O2 , Cl2 , H2S. B. S, SO2 , Cl2 C. F2, S , SO3 D. Cl2 , SO2, H2SO4 |
|
| Câu 18. | Dãy chất tác dụng được với dung dịch H2SO4 đặc nguội là: A. CaCO3, Al, CuO B. Cu, MgO, Fe(OH)3 C. S, Fe, KOH D. CaCO3, Au, NaOH |
|
| Câu 19. | Có 3 bình đựng 3 chất khí riêng biệt: O2, O3, H2S lần lượt cho từng khí này qua dung dịch KI có pha thêm hồ tinh bột, chất khí làm dung dịch chuyển màu xanh là : A. O2 B. H2S C. O3 D. O3 và O2 |
|
| Câu 20. | Cho 21,75 gam MnO2 tác dụng với dung dịch HCl đặc sinh ra V lít khí Cl2 (đktc), biết hiệu suất phản ứng là 80%. Giá trị của V là: A. 4,48 lít B. 6,72 lít C. 5,6 lít D. 2,24 lít |
II- Tự luận: (5,0 điểm)
Bài 1. (2,5 điểm)
Hoàn thành các phương trình hóa học sau (ghi rõ điều kiện phản ứng nếu có).
- Al + Cl2 ………………………………………………………………………………………………
- Cu(OH)2+ HCl ………………………………………………………………………………………
- C + H2SO4đặc, nóng ……………………………………………………………………………….
- Ba(OH)2+ Na2SO4 ………………………………………………………………………………..
- e.Mg + H2SO4đặc, nóng SO2 + H2S + .............................................................................................
(biết tỉ lệ mol SO2 và H2S là 2 : 3)
Bài 2: (2,5 điểm)
Hòa tan 15 gam hỗn hợp X gồm Al và Cu vào dung dịch H2SO4 98% (đặc, nóng, dư). Sau khi phản ứng xảy ra hoàn toàn, thấy thoát ra 10,08 lít khí SO2 là sản phẩm khử duy nhất (ở đktc) và thu được dung dịch Y.
- Tính thành phần % khối lượng mỗi kim loại trong X. (1,5 điểm)
- Để trung hòa hết lượng axit dư trong dung dịch Y cần dùng 500 ml dung dịch NaOH 3M. Tính khối lượng dung dịch H2SO498% ban đầu. (0,5 điểm)
- Lượng axit trên hòa tan vừa hết m gam hỗn hợp FeS2, Cu2S (tỉ lệ mol tương ứng 1:3) thu được sản phẩm khử duy nhất là SO2. Tính khối lượng muối thu được sau phản ứng. (0,5 điểm.
(Cho: Al=27; Fe =56; Mg=24; Zn=65; Ba=137; O=16; H =1; Cu=64; Na=23; O=16; Mn=55; S=32; Cl=35,5)
(Học sinh không được sử dụng Bảng tuần hoàn)
Đáp án đề thi cuối học kì 2 môn Hóa học lớp 10
I – Trắc nghiệm (5,0 điểm)
| Câu | 111 | 112 | 113 | 114 | 115 | 116 | 117 | 118 |
| Câu 1. | A | D | A | C | B | C | B | C |
| Câu 2. | B | C | C | B | C | B | C | D |
| Câu 3. | A | B | C | B | D | A | B | B |
| Câu 4. | C | D | C | C | D | C | B | B |
| Câu 5. | C | C | C | C | B | C | D | C |
| Câu 6. | C | B | A | B | A | A | C | A |
| Câu 7. | D | B | D | A | C | D | B | B |
| Câu 8. | A | B | D | C | B | D | D | A |
| Câu 9. | B | A | C | A | B | C | A | D |
| Câu 10. | B | D | B | C | A | D | C | C |
| Câu 11. | B | C | A | B | C | C | C | A |
| Câu 12. | C | C | B | B | B | B | D | A |
| Câu 13. | D | C | B | D | D | A | A | C |
| Câu 14. | C | A | B | B | C | D | C | D |
| Câu 15. | A | B | D | C | C | B | A | C |
| Câu 16. | B | A | C | D | C | B | D | B |
| Câu 17. | B | C | B | A | A | B | B | B |
| Câu 18. | C | D | A | D | B | B | B | B |
| Câu 19. | D | A | B | A | A | C | A | D |
| Câu 20. | D | B | D | D | D | A | C | C |
Mời các bạn sử dụng file tải về để xem trọn bộ đề thi học kì 2 môn Hóa học lớp 10 trường THPT Đa Phúc.











