Đề cương ôn tập học kì I Hóa học 9
Tổng hợp kiến thức cần nắm vững cần thiết trong đề thi HK1 Hóa học 9 sắp tới
Chương 1: CÁC LOẠI HỢP CHẤT VÔ CƠ
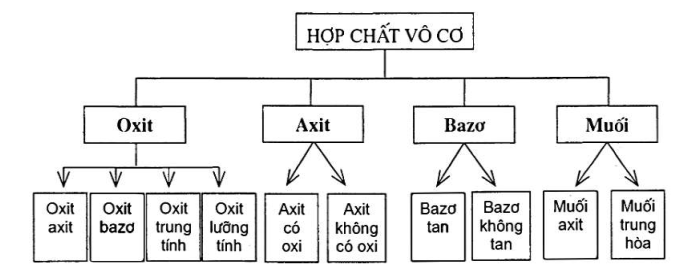
I. PHÂN LOẠI HỢP CHẤT VÔ CƠ
II. OXIT
Oxit là hợp chất của nguyên tố oxi với một nguyên tố hóa học khác
CTTQ: MxOy
VD: Na2O; Fe2O3
Cách gọi tên:
+ Tên oxit axit = tên nguyên tố phi kim (kèm tiền tố chỉ số nguyên tử kim loại hoặc phi kim) + oxit (kèm tiền tố chỉ số nguyên tử oxi)
Một số tiền tố chỉ số nguyên tử: mono : 1; đi : 2; Tri : 3.....
VD: CO2 : Cacbon dioxit
P2O5: Đi photpho penta oxit
+ Tên oxit bazo = Tên nguyên tố kim loại (kèm hóa trị nếu nguyên tố kim loại có nhiều hóa trị) + oxit
VD: Fe2O3 : Sắt (III) oxit
Tính chất hóa học
|
Oxit axit |
Oxit bazo |
|
a. Tác dụng với nước → dung dịch axit VD: SO2 + H2O → H2SO3 b. Tác dụng với dd bazo → Muối + H2O CO2 + Ca(OH)2 → CaCO3 + H2O c. Tác dụng với oxit bazo → Muối (Một số oxit bazo có thể tác dụng với oxit axit: K2O, Na2O, BaO, CaO) SO2 + BaO → BaSO3 |
a. Tác dụng với nước → Dung dịch bazo (kiềm) BaO + H2O → Ba(OH)2 b. Tác dụng với axit → Muối + Nước FeO + H2SO4 → FeSO4 + H2O c. Tác dụng với oxit axit → Muối SO2 + BaO → BaSO3 |
|
Oxit lưỡng tính |
Oxit trung tính |
|
Oxit lưỡng tính vừa tác dụng với dung dịch axit, vừa tác dụng với dung dịch bazo để tạo thành muối và nước Al2O3 + 6HCl → 2AlCl3 + 3H2O Al2O3 + 2NaOH → NaAlO2 + H2O |
Oxit trung tính là những oxit không tác dụng với axit, bazo hay với nước VD: NO, CO, N2O,... |
III. AXIT
Axit là hợp chất mà phân tử có một hay nhiều nguyên tử hidro liên kết với gốc axit.
CTTQ: HnA
VD: HCl, H2SO4, HNO3, H3PO4...
Cách gọi tên:
a. Axit không có oxi: Tên axit = Axit + tên phi kim + hidric
VD: HCl: axit clohidric
HF: axit flohidric
b. Axit có oxi: Tên axit = Axit + tên phi kim + ic
VD: H2SO4 : Axit sunfuric
HNO3: Axit nitric
Axit có ít nguyên tử oxi : Tên axit = Axit + tên phi kim + ơ
VD: H2SO3 : Axit sunfurơ
Tính chất hóa học
a. Đổi màu chất chỉ thị
Axit làm đổi màu quỳ tím sang màu đỏ
b. Tác dụng với oxit bazo => Muối + H2O
VD: H2SO4 + BaO → BaSO4 + H2O
c. Tác dụng với bazo => Muối + H2O
VD: 2HCl + Cu(OH)2 → CuCl2 + 2H2O
d. Tác dụng với kim loại => Muối + H2
(dung dịch HCl, H2SO4 tác dụng KL (trừ một số KL: Ag, Cu, ...)
H2SO4 + Fe → FeSO4 + H2
e. Tác dụng với muối => Muối mới + axit mới
(Sản phẩm sinh ra là chất dễ bay hơi. hoặc muối mới không tan)
* Lưu ý:
Al, Fe, Cr thụ động trong HNO3 đặc nguội, H2SO4 đặc nguội
H2SO4 đặc nóng, HNO3 tác dụng với hầu hết các kim loại (trừ Au, Pt) và không sinh ra khí H2
Cu + H2SO4 đặc → CuSO4 + SO2 + 2H2O
IV. BAZO
Bazo là hợp chất gồm một nguyên tử kim loại liên kết cới một hay nhiều nhóm hidroxit (OH)
CTTQ: M(OH)n
VD: NaOH; Fe(OH)3
Cách gọi tên bazo:
Tên bazo = Tên nguyên tố kim loại (kèm hóa trị nếu nguyên tố hóa trị có nhiều hóa trị) + hidroxit
VD: Fe(OH)2 : Sắt (II) hidroxit
NaOH: Natri hiroxit
Tính chất hóa học
- Tác dụng với axit => Muối + H2O
Ca(OH)2 + H2SO4 → CaSO4 + 2H2O
- Bazo tan làm đổi màu chất chỉ thị
+ Qùy tím chuyển thành màu xanh, phenol phtalein chuyển thành màu hồng
- Bazo tan tác dụng với oxit axit => Muối + H2O
Ba(OH)2 + CO2 → BaCO3 + H2O
- Bazo tan tác dụng với dung dịch muối => Muối mới + Bazo mới
(ĐK: Sản phẩm sinh ra phải có ít nhất 1 chất kết tủa)
2NaOH + CuSO4 → Cu(OH)2 + Na2SO4
- Bazo không tan bị nhiệt phân hủy => Oxit bazo + H2O
Cu(OH)2 .\(\xrightarrow{{{t}^{0}}}\).CuO + H2O
V. MUỐI
Muối là hợp chất mà phân tử gồm một hay nhiều nguyên tử kim loại liên kết với một hay nhiều gốc axit
CTTQ: AxBy
A là kim loại, B là gốc axit
VD: K2SO4; CaCO3, ...
Tên gọi:
Muối trung hòa: Tên nguyên tố kim loại (kèm hóa trị nếu nguyên tố kim loại có nhiều hóa trị) + Tên gốc axit
VD: Na2SO4 : Natri sunfat
Muối axit : Tên nguyên tố kim loại + hidro + tên gốc axit
VD: NaHCO3 : Natri hidrocacbonat
Tính chất hóa học
-Dung dịch muối + kim loại → Muối mới + KL mới
VD: CuSO4 + Fe → FeSO4 + Cu
- Muối + axit → Muối mới + axit mới
(Sản phẩm sinh ra phải có chất kết tủa, hoặc khí bay ra)
VD: CaCO3 + HCl → CaCl2 + CO2 + H2O
- Dung dịch muối + dung dịch bazo => Muối mới + bazo mới
(Sản phẩm sinh ra phải có ít nhất 1 chất kết tủa)
VD: CuSO4 + NaOH → Cu(OH)2 + Na2SO4
- Dung dịch muối + dung dịch muối => 2 muối mới
(Sản phẩm sinh ra phải có ít nhất 1 chất kết tủa)
VD: Na2SO4 + BaCl2 → BaSO4 + NaCl
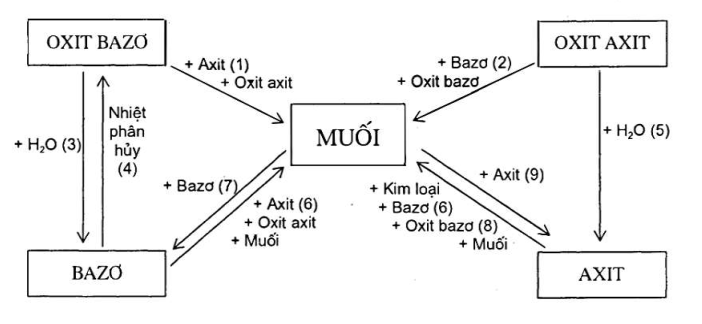
VI. Mối quan hệ giữa các hợp chất vô cơ
CHƯƠNG 2: KIM LOẠI
I. Tính chất vật lý
- Tính chất chung: Tính dẻo, dẫn điện, dẫn nhiệt và ánh kim
- Tính chất riêng: Khối lượng riêng (D) ; nhiệt độ nóng chảy, độ cứng
II. Tính chất hóa học
- Tác dụng với phi kim
Tác dụng với oxi => Oxit kim loại
(Trừ một số kl như Ag, Au, Pt)
Fe + O2 → Fe2O3
Tác dụng với phi kim khác => Muối
Ca + Cl2 → CaCl2
- Tác dụng với axit
+ KL + Axit (HCl ; H2SO4 loãng) => Muối + H2
Mg + H2SO4 → MgSO4 + H2
+ KL + Axit (HNO3, H2SO4 đ) => Muối + Sản phẩm khử + H2O
Cu + H2SO4 đ → CuSO4 + SO2 + H2O
- Tác dụng với dung dịch muối => Muối mới + KL mới
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
III. Dãy hoạt động hóa học của kim loại
K Na Ba Ca Mg Ak Zn Fe (H) Cu Hg Ag Pt Au
Ý nghĩa dãy hoạt động hóa học của kim loại:
+ Đi từ trái sang phải, mức độ hóa học của kim loại giảm dần
+ Kim loại đứng trước Mg, phản ứng với nước ở điều kiện thường tạo thành dung dịch kiềm giải phóng khí hidro
+ Kim loại đứng trước H phản ứng với một số dung dịch axit (HCl, H2SO4, ...) giải phóng khí hidro
+ Kim loại đứng trước (trừ Na, K, Ca, Ba, ...) đẩy được kim loại đứng sau ra khỏi dung dịch muối
IV. SO SÁNH TÍNH CHẤT CỦA NHÔM VÀ SẮT
|
|
Nhôm – Al (NTK : 27) |
Sắt – Fe (NTK : 56) |
|
1. Tính chất vật lí |
Màu trắng bạc, có ánh kim, nhẹ, dẻo, dẫn điện, dẫn điện tốt |
Màu trắng xám, có ánh kim, nặng, dẻo, dẫn điện, dẫn nhiệt tốt, nhưng kém hơn nhôm |
|
2. Tính chất hóa học |
Đều mang đầy đủ tính chất hóa học của KL |
|
|
a. Với phi kim |
2Al + 3S \(\xrightarrow{{{t}^{0}}}\)Al2S3 |
Fe + S \(\xrightarrow{{{t}^{0}}}\)FeS |
|
b. Với oxi |
2Al + O2 → 2Al2O3 |
Fe + O2 → Fe3O4 |
|
c. Với axit |
2Al + 6HCl → 2AlCl3 + 3H2 |
Fe + 2HCl → FeCl2 + H2 |
|
Cả Al, Fe đều không tác dụng với HNO3, H2SO4 đặc nguội |
||
|
d. Với dung dịch muối |
2Al + 3FeSO4 → Al2(SO4)3 + 3Fe |
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag |
|
e. Với dung dịch kiềm |
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2 |
Không phản ứng |
|
3. Hợp chất |
Al2O3 và Al(OH)3 có tính lưỡng tính Al2O3 + 6HCl → AlCl3 + 3H2 Al2O3 + 2NaOH → 2NaAlO2 + H2O Al(OH)3 + 3HCl → AlCl3 + 3H2O Al(OH)3 + NaOH → NaAlO2 + 2H2O |
FeO; Fe2O3; Fe3O4 là oxit bazo |
|
4. Sản xuất |
Nguyên liệu: Quăng boxit có thành phần chủ yếu là Al2O3 và criolit 2Al2O3 \(\xrightarrow{{{t}^{0}}}\) 4Al + 3O2 |
Nguyên liệu: Quặng sắt (Manhetit, hemantit,...) |
V. Hợp kim
1. Hợp kim
Là chất rắn thu được khi làm nguội hỗn hợp nóng chảy của nhiều kim loại khác nhau hoặc của kim loại và phi kim.
|
Gang |
Thép |
|
- Gang là hợp kim của sắt với cacbon và một số nguyên tố khác (Mn, Si, S, ...) trong đó hàm lượng C từ 2 – 5% - Có 2 loại gang: + Gang trắng dùng để luyện thép + Gang xám để chế tạo máy móc, thiết bị |
- Thép là hợp kim của sắt và Cacbon, một số nguyên tố khác trong đó làm lượng C < 2% - Thép thường được dùng chế tạo máy móc, công cụ lao động trong xây dựng |
|
Sản xuất: * Nguyên liệu - Quặng sắt (Manhetit: Fe3O4; Hemantit: Fe2O3,...) - Than cốc, không khí, ... Dùng CO khử các oxit sắt ở nhiệt độ cao trong lò luyện kim. * Qúa trình sản xuất: - Phản ứng tạo CO: C + O2 \(\xrightarrow{{{t}^{0}}}\) CO2 C + CO2 \(\xrightarrow{{{t}^{0}}}\) 2CO - Khử oxit sắt Fe2O3 + 3CO \(\xrightarrow{{{t}^{0}}}\) 2Fe + 3CO2 Fe3O4 + 3CO \(\xrightarrow{{{t}^{0}}}\) 3Fe + 4CO2 - Tạo xỉ: CaO + SiO2 → CaSiO3 |
Sản xuất: * Nguyên liệu: - Gang; - Sắt phế liệu - Khí oxi * Nguyên tắc sản xuất: Oxi hóa các kim loại, phi kim để loại khỏi gang phần lớn các nguyên tố C, S, P, Mn, Si, ... * Qúa trình sản xuất: - Phản ứng tạo FeO: 2Fe + O2 \(\xrightarrow{{{t}^{0}}}\) 2FeO - FeO oxit hóa các nguyên tố khác có trong gang như: C, S, P, Mn, Si, ... thành oxit để loại ra khỏi thép FeO + Mn \(\xrightarrow{{{t}^{0}}}\) Fe + MnO |
VI. SỰ ĂN MÒN KIM LOẠI VÀ BẢO VỆ KIM LOẠI KHÔNG BỊ ĂN MÒN
1. Sự ăn mòn kim loại
Sự phá hủy kim loại và hợp kim trong môi trường tự nhiên do tác dụng hóa học gọi là sự ăn mòn kim loại
2. Những yếu tố ảnh hưởng đến sự ăn mòn kim loại
- Nhiệt độ: Nhiệt độ cao, ăn mòn nhanh
- Các chất trong môi trường: ẩm, nhiều chất OXH thì ăn mòn nhanh
3. Các phương pháp bảo vệ kim loại không bị ăn mòn
- Ngăn không cho kim loại tiếp xúc với môi trường xung quanh
- Chế tạo các hợp kim có khả năng chống, chịu ăn mòn
CHƯƠNG 3: PHI KIM
I. TÍNH CHẤT VẬT LÝ CỦA PHI KIM
- Ở điều kiện thường, các phi kim tồn tại ở cả 3 trạng thái: rắn, lỏng, khí.
- Phần lớn các phi kim không dẫn điện, dẫn nhiệt kém, không có ánh kim
- Một số phi kim độc như: Cl2, Br2, I2, ...
II. TÍNH CHẤT HÓA HỌC
1. Tác dụng với kim loại => Muối (hoặc oxit)
VD: Hg + S → HgS
2. Tác dụng với hidro => Hợp chất khí
VD: H2 + Cl2 → 2HCl
3. Mức độ hoạt động của phi kim
Mức độ hoạt động hóa học mạnh hay yếu của các phi kim xét dựa vào khả năng tác dụng của phi kim với kim loại và hidro
Thứ tự hoạt động giảm dần theo dãy:
F > O > Cl > Br > S > P > C > Si
III. Clo
Tính chất vật lý:
Là chất khí màu vàng lục, mùi hắc, tan một phần trong nước. Clo là khí độc
Tính chất hóa học:
Clo có những tính chất hóa học chung cua phi kim
+ Clo + kim loại → Muối
Cl2 + Fe → FeCl3
+ Clo + Hidro => Khí hidro clorua
Cl2 + H2 → 2HCl
Tính chất khác:
Tác dụng với nước:
Cl2 + H2O → HCl + HClO
Cl2 + NaOH → NaCl + NaClO + H2O
Điều chế
Trong phòng thí nghiệm:
Dùng chất oxi hóa mạnh (MnO2, KMnO4, ...) + HCl đặc
VD: MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
Trong công nghiệp:
Điện phân dung dịch NaCl bão hòa có màng ngăn xốp
2NaCl + 2H2O → 2NaOH + Cl2 + H2
IV. CACBON VÀ HỢP CHẤT CACBON
1. Dạng thù hình của cacbon
Có 3 loại thù hình chính: Kim cương, than chì, cacbon vô định hình
2. Tính chất của cacbon
+ Tính hấp phụ: cacbon vô định hình có khả năng hấp phụ chất khí, chất màu trên bề mặt chúng
+ Tính chất hóa học: Mang đầy đủ tính chất hóa học của phi kim
a, Tác dụng với oxi:
C + O2 \(\xrightarrow{{{t}^{0}}}\) CO2
b, Tác dụng với oxi KL => KL + CO2
C + ZnO \(\xrightarrow{{{t}^{0}}}\) Zn + CO2
3. Hợp chất của cacbon
Các oxit của cacbon
|
Tính chất |
CO |
CO2 |
|
Tính chất vật lý |
Khí không màu, không mùi, ít tan trong nước, nhẹ hơn không khí, rất độc |
Khí không màu, không mùi, nặng hơn không khí, không duy trì sự sống và sự cháy |
|
Tính chất hóa học |
Là oxit trung tính Là chất khử mạnh + Tác dụng với oxit KL (KL đứng sau Al) => KL + CO2 CO + FeO \(\xrightarrow{{{t}^{0}}}\) Fe + CO2 + Tác dụng với oxi: 2CO + O2 \(\xrightarrow{{{t}^{0}}}\) 2CO2 |
+ Tác dụng với nước: CO2 + H2O H2CO3 + Tác dụng với dung dịch kiềm CO2 + NaOH → NaHCO3 CO2 + NaOH → Na2CO3 + H2O + Tác dụng với oxit bazo CO2 + CaO → CaCO3 |
Search google: "từ khóa + timdapan.com" Ví dụ: "Đề cương ôn tập học kì I Hóa học 9 timdapan.com"