Bài 3 trang 9 SGK Hóa học 9
Giải bài 3 trang 9 SGK Hóa học 9. 200ml dung dịch HCl
Đề bài
200ml dung dịch HCl có nồng độ 3,5M hòa tan vừa hết 20 g hỗn hợp hai oxit CuO và Fe2O3
a) Viết các phương trình hóa học
b) Tính khối lượng của mỗi oxit có trong hỗn hợp ban đầu.
Phương pháp giải - Xem chi tiết
Đổi số mol của HCl
Gọi số mol của CuO và lần lượt là x, y (mol)
PTHH:
CuO + 2HCl → CuCl2 + H2O
Phản ứng x → 2x x (mol)
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
Phản ứng: y → 6y 2y (mol)
Giải hệ 2 ẩn 2 phương trình
\(\left\{ \begin{gathered}
{n_{HCl}} = x + \,y\, = 0,7 \hfill \\
m{\,_{hh}}\, = 80x\, + 160y = 20 \hfill \\
\end{gathered} \right. = > \left\{ \begin{gathered}
x = ? \hfill \\
y = ? \hfill \\
\end{gathered} \right.\)
Lời giải chi tiết
Số mol HCl = 3,5 . 0,2 = 0,7 mol
Gọi x, y là số mol của CuO và Fe2O3
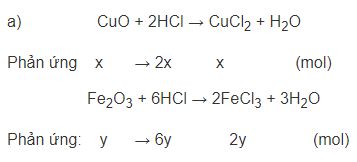
Theo khối lượng hỗn hợp hai oxit và theo số mol HCl phản ứng, ta lập được hệ phương trình đại số:
\(\left\{ \begin{gathered}
{n_{HCl}} =2 x + \,6y\, = 0,7 \hfill \\
m{\,_{hh}}\, = 80x\, + 160y = 20 \hfill \\
\end{gathered} \right. \Rightarrow \left\{ \begin{gathered}
x = 0,05 \hfill \\
y = 0,1 \hfill \\
\end{gathered} \right.\)
\({n_{CuO}} = 0,05\,mol\)
\({n_{F{e_2}{O_3}}} = 0,1\,mol\)
b) \({m_{CuO}}= 0,05 . 160 = 4\, g\)
\({m_{F{e_2}{O_3}}}= 20 - 4 = 16\, g\)
Search google: "từ khóa + timdapan.com" Ví dụ: "Bài 3 trang 9 SGK Hóa học 9 timdapan.com"







