Bài 14: Bài thực hành 2 Tính chất của một số hợp chất nitơ, photpho
1. Nội dung ôn tập
a. Thí nghiệm 1: Tính Oxi hóa của HNO3 đặc và loãng
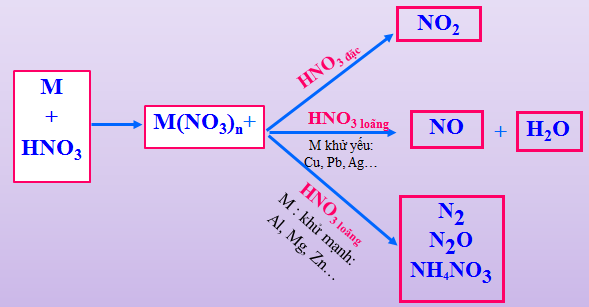
HNO3 có số oxi hóa +5 có thể bị khử thành: N2, N2O, NO, NO2, NH4NO3 tuỳ theo nồng độ HNO3 và khả năng khử của chất tham gia.
Hình 1: Các sản phẩm khử của HNO3
Với M là kim loại, n là hóa trị cao nhất của M
* Lưu ý:
N2O là khí vui, khí gây cười.
N2 không duy trì sự sống, sự cháy
NH4NO3 không sinh ra ở dạng khí, nhưng khi cho kiềm vào dd, thấy có khí mùi khai.
- Oxi hoá hầu hết kim loại (trừ Au, Pt).
3Cu +8HNO3(l) → 3Cu(NO3)2 + 2NO + 4H2O
Cu + 4HNO3đ → Cu(NO3)2 + 2NO2 + 2H2O
- Fe, Al, Cr thụ động hoá với HNO3 đặc, nguội.
b. Thí nghiệm 2: Tính oxi hoá KNO3 nóng chảy
Các muối nitrat đều kém bền bởi nhiệt, khi đun nóng muối nitrat có tính Oxi hóa mạnh.
Sản phẩm phân huỷ phụ thuộc vào bản chất của cation kim loại:
- Kim loại đứng trước Mg → muối Nitrit + O2
Ví dụ: 2KNO3 → 2KNO2 + O2
- Từ Mg đến Cu → Oxit kim loại + NO2 + O2
Ví dụ: 2Cu(NO3)2 → 2CuO + 4NO2 + O2
- Kim loại sau Cu → Kim loại + NO2 + O2
Ví dụ: 2AgNO3 → 2Ag + 2NO2 + O2
c. Thí nghiệm 3: Phân biệt một số loại phân bón hóa học
- Nhận biết gốc SO42- bằng dung dịch Ba2+ với hiện tượng xuất hiện kết tủa trắng BaSO4
- Nhận biết gốc amoni (NH4+) bằng bazơ với hiện tượng sinh ra khí có mùi khai, chính là NH3
2. Kĩ năng thí nghiệm
- Không dùng tay cầm trực tiếp hoá chất.
- Không đổ hoá chất này vào hoá chất khác ngoài chỉ dẫn.
- Không đổ lại hoá chất thừa lại lọ đựng ban đầu.
- Không dùng hoá chất nếu không biết hoá chất gì.
- Không nếm hoặc ngửi trực tiếp hoá chất.
- Khi mở lọ hoá chất và lấy hoá chất không để dây ra bàn, dùng xong đậy nắp lại ngay.
3. Thí nghiệm 1: Tính Oxi hóa của HNO3 đặc và loãng
- Các em chú ý quan sát kĩ năng tiến hành thí nghiệm cũng như hiện tượng xảy ra ở đoạn video dưới đây:
Video 1: So sánh phản ứng của Đồng và axit nitric đặc, axit nitric loãng
- Hiện tượng:
+ Ở ống nghiệm chứa Cu và HNO3 đặc xuất hiện khí màu nâu đỏ, nhiều, dung dịch chuyển sang màu xanh.
+ Ở ống nghiệm chứa Cu và HNO3 loãng xuất hiện khí không mùa, trong không khí chuyển thành nâu đỏ, với lượng khí ít hơn ở ống nghiệm chứa HNO3 đặc. Dung dịch cũng có màu xanh lam.
- Giải thích:
+ Cho mảnh Cu vào ống nghiệm chứa HNO3 đặc có khí NO2 màu nâu bay ra vì HNO3 đặc bị khử đến NO2. Dung dịch chuyển sang màu xanh do tạo ra Cu(NO3)2
+ Cho mảnh Cu vào ống nghiệm chứa HNO3 loãng và đun nóng có khí NO không màu bay ra, sau chuyển thành NO2 màu nâu đỏ. Dung dịch chuyển sang màu xanh lam của Cu(NO3)2
- Phương trình hóa học:
Cu + 4HNO3 đặc → Cu(NO3)2 + 2NO2 + 2H2O
3Cu + 8HNO3 loãng → 3Cu(NO3)2 + 2NO + 4H2O
4. Thí nghiệm 2: Tính oxi hoá KNO3 nóng chảy
Thí nghiệm này, các em có thể sử dụng NaNO3 để thay thế KNO3 cũng được vì đây đều là muối nitrat của kim loại kiềm
- Các em chú ý quan sát thao tác tiến hành thí nghiệm cũng như hiện tượng diễn ra trong phản ứng sau:
Video 2: Nhiệt phân muối Natri nitrat
- Hiện tượng: Que đóm bùng cháy kèm theo tiếng nổ lách tách.
- Giải thích: Que đóm sẽ bùng cháy trong KNO3 nóng chảy, có tiếng nổ lách tách đó là do KNO3 nhiệt phân giải phóng khí oxi.
2KNO3 → 2KNO2 + O2
5. Phân biệt một số loại phân hóa học
- Cách tiến hành: Nhận biết các dung dịch đựng trong các lọ mất nhãn đánh số 1,2,3: KCl, Na3PO4; (NH4)2SO4
+ Bước 1: Trích dẫn 3 dung dịch ra 3 mẫu thử
+ Bước 2: Nhỏ dung dịch NaOH vào lần lượt 3 mẫu thử
+ Bước 3: Nhỏ dung dịch AgNO3 vào các mẫu thử còn lại
- Hiện tượng và giải thích:
+ Nhỏ dd NaOH vào các ống nghiệm, đun nhẹ, ống nào có mùi khai NH3 bay ra, làm quì tím ẩm hoá xanh: nhận biết được (NH4)2SO4.
+ Nhỏ dd AgNO3 vào 2 ống nghiệm đựng KCl, Na3PO4, ống nghiệm nào xuất hiện kết tủa màu vàng Ag3PO4: nhận biết được Na3PO4, kết tủa trắng là KCl
+ Phương trình hóa học
NH4+ + OH- → NH3 (khí mùi khai) + H2O
AgNO3 + KCl → AgCl (kết tủa trắng) + KNO3
AgNO3 + AgNO3 → không xảy ra phản ứng
1. Nội dung ôn tập
a. Thí nghiệm 1: Tính Oxi hóa của HNO3 đặc và loãng
HNO3 có số oxi hóa +5 có thể bị khử thành: N2, N2O, NO, NO2, NH4NO3 tuỳ theo nồng độ HNO3 và khả năng khử của chất tham gia.
Hình 1: Các sản phẩm khử của HNO3
Với M là kim loại, n là hóa trị cao nhất của M
* Lưu ý:
N2O là khí vui, khí gây cười.
N2 không duy trì sự sống, sự cháy
NH4NO3 không sinh ra ở dạng khí, nhưng khi cho kiềm vào dd, thấy có khí mùi khai.
- Oxi hoá hầu hết kim loại (trừ Au, Pt).
3Cu +8HNO3(l) → 3Cu(NO3)2 + 2NO + 4H2O
Cu + 4HNO3đ → Cu(NO3)2 + 2NO2 + 2H2O
- Fe, Al, Cr thụ động hoá với HNO3 đặc, nguội.
b. Thí nghiệm 2: Tính oxi hoá KNO3 nóng chảy
Các muối nitrat đều kém bền bởi nhiệt, khi đun nóng muối nitrat có tính Oxi hóa mạnh.
Sản phẩm phân huỷ phụ thuộc vào bản chất của cation kim loại:
- Kim loại đứng trước Mg → muối Nitrit + O2
Ví dụ: 2KNO3 → 2KNO2 + O2
- Từ Mg đến Cu → Oxit kim loại + NO2 + O2
Ví dụ: 2Cu(NO3)2 → 2CuO + 4NO2 + O2
- Kim loại sau Cu → Kim loại + NO2 + O2
Ví dụ: 2AgNO3 → 2Ag + 2NO2 + O2
c. Thí nghiệm 3: Phân biệt một số loại phân bón hóa học
- Nhận biết gốc SO42- bằng dung dịch Ba2+ với hiện tượng xuất hiện kết tủa trắng BaSO4
- Nhận biết gốc amoni (NH4+) bằng bazơ với hiện tượng sinh ra khí có mùi khai, chính là NH3
2. Kĩ năng thí nghiệm
- Không dùng tay cầm trực tiếp hoá chất.
- Không đổ hoá chất này vào hoá chất khác ngoài chỉ dẫn.
- Không đổ lại hoá chất thừa lại lọ đựng ban đầu.
- Không dùng hoá chất nếu không biết hoá chất gì.
- Không nếm hoặc ngửi trực tiếp hoá chất.
- Khi mở lọ hoá chất và lấy hoá chất không để dây ra bàn, dùng xong đậy nắp lại ngay.
3. Thí nghiệm 1: Tính Oxi hóa của HNO3 đặc và loãng
- Các em chú ý quan sát kĩ năng tiến hành thí nghiệm cũng như hiện tượng xảy ra ở đoạn video dưới đây:
Video 1: So sánh phản ứng của Đồng và axit nitric đặc, axit nitric loãng
- Hiện tượng:
+ Ở ống nghiệm chứa Cu và HNO3 đặc xuất hiện khí màu nâu đỏ, nhiều, dung dịch chuyển sang màu xanh.
+ Ở ống nghiệm chứa Cu và HNO3 loãng xuất hiện khí không mùa, trong không khí chuyển thành nâu đỏ, với lượng khí ít hơn ở ống nghiệm chứa HNO3 đặc. Dung dịch cũng có màu xanh lam.
- Giải thích:
+ Cho mảnh Cu vào ống nghiệm chứa HNO3 đặc có khí NO2 màu nâu bay ra vì HNO3 đặc bị khử đến NO2. Dung dịch chuyển sang màu xanh do tạo ra Cu(NO3)2
+ Cho mảnh Cu vào ống nghiệm chứa HNO3 loãng và đun nóng có khí NO không màu bay ra, sau chuyển thành NO2 màu nâu đỏ. Dung dịch chuyển sang màu xanh lam của Cu(NO3)2
- Phương trình hóa học:
Cu + 4HNO3 đặc → Cu(NO3)2 + 2NO2 + 2H2O
3Cu + 8HNO3 loãng → 3Cu(NO3)2 + 2NO + 4H2O
4. Thí nghiệm 2: Tính oxi hoá KNO3 nóng chảy
Thí nghiệm này, các em có thể sử dụng NaNO3 để thay thế KNO3 cũng được vì đây đều là muối nitrat của kim loại kiềm
- Các em chú ý quan sát thao tác tiến hành thí nghiệm cũng như hiện tượng diễn ra trong phản ứng sau:
Video 2: Nhiệt phân muối Natri nitrat
- Hiện tượng: Que đóm bùng cháy kèm theo tiếng nổ lách tách.
- Giải thích: Que đóm sẽ bùng cháy trong KNO3 nóng chảy, có tiếng nổ lách tách đó là do KNO3 nhiệt phân giải phóng khí oxi.
2KNO3 → 2KNO2 + O2
5. Phân biệt một số loại phân hóa học
- Cách tiến hành: Nhận biết các dung dịch đựng trong các lọ mất nhãn đánh số 1,2,3: KCl, Na3PO4; (NH4)2SO4
+ Bước 1: Trích dẫn 3 dung dịch ra 3 mẫu thử
+ Bước 2: Nhỏ dung dịch NaOH vào lần lượt 3 mẫu thử
+ Bước 3: Nhỏ dung dịch AgNO3 vào các mẫu thử còn lại
- Hiện tượng và giải thích:
+ Nhỏ dd NaOH vào các ống nghiệm, đun nhẹ, ống nào có mùi khai NH3 bay ra, làm quì tím ẩm hoá xanh: nhận biết được (NH4)2SO4.
+ Nhỏ dd AgNO3 vào 2 ống nghiệm đựng KCl, Na3PO4, ống nghiệm nào xuất hiện kết tủa màu vàng Ag3PO4: nhận biết được Na3PO4, kết tủa trắng là KCl
+ Phương trình hóa học
NH4+ + OH- → NH3 (khí mùi khai) + H2O
AgNO3 + KCl → AgCl (kết tủa trắng) + KNO3
AgNO3 + AgNO3 → không xảy ra phản ứng