Bài 8: Amoniac và muối amoni
1. AMONIAC
1.1. Cấu tạo phân tử
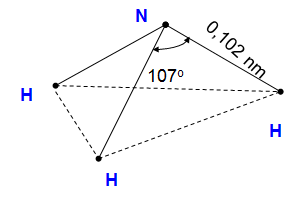
Hình 1: Sơ đồ cấu tạo của phân tử NH3
- Nguyên tử N liên kết với 3 nguyên tử H bằng 3 liên kết cộng hóa trị có cực.
- Nguyên tử N còn có 1 cặp e hoá trị.
- Nguyên tử N có số oxi hóa thấp nhất -3
- Phân tử có cấu tạo không đối xứng nên phân tử NH3 phân cực.
1.2. Tính chất vật lý
- Là chất khí không màu, mùi khai, xốc, nhẹ hơn không khí
- Tan nhiều trong nước, tạo thành dd có tính kiềm
Video 1: Sự hòa tan của Amoniac trong nước
- Khí NH3 tan nhiều trong nước làm giảm P trong bình và nước bị hút vào bình. Phenolphtalein chuyển thành màu hồng ⇒ NH3 có tính bazơ.
- Dung dịch NH3 đậm đặc trong phòng thí nghiệm có nồng độ 25% (N = 0,91g/cm3).
1.3. Tính chất hóa học
Tính bazơ yếu
Tác dụng với nước
- Khi hoà tan khí NH3 vào nước, 1 phần các phân tử NH3 phản ứng tạo thành dd bazơ ⇒ dd NH3 là bazơ yếu:
NH3 + H2O ⇔ NH4++ OH-
- Làm quỳ tím chuyển sang màu xanh
Tác dụng với dung dịch bazơ
- Dung dịch NH3 có khả năng làm kết tủa nhiều hidroxít kim loại
AlCl3 + 3NH3 + 3 H2O → Al(OH)3 + 3 NH4Cl
Al3++3NH3+3H2O → Al(OH)3 + 3NH4+
Tác dụng với axít
2NH3 + H2SO4 → (NH4)2SO4
NH3 (k) + HCl (k) → NH4Cl
(không màu) (ko màu) (khói trắng)
Video 2: Amoniac tác dụng với axit clohidric
Tính khử
Trong phân tử NH3, N có số oxi hóa là -3. Nitơ có các số oxi hóa là -3,0,+1,+2,+3,+4,+5. Như vậy trong các phản ứng hóa học khi có sự thay đổi số oxi hóa, số oxi hóa của N trong NH3 chỉ có thể tăng lên
→ thể hiện tính khử.
Tác dụng với oxi
Video 3: Thí nghiệm giữa NH3 và Oxi
NH3 được tạo ra từ phản ứng của NH4Cl và CaO
Khí O2 được tạo ra từ phản ứng của KClO3 và MnO2
- Hiện tượng: Que đóm đang cháy bỗng vụt tắt
- Giải thích: Khí N2 không duy trì sự cháy 4 NH3 + 3O2 → 2N2 + 6 H2O
Tác dụng với Clo
2NH3 + 3Cl2 → N2 + 6 HCl
Nếu NH3 dư : NH3 + HCl → NH4Cl (khói trắng)
* Kết luận: Amoniac có các tính chất hoá học cơ bản: tính bazơ yếu và tính khử
1.4. Ứng dụng
- Sản xuất HNO3
- Sản xuất phân đạm và dd NH3 có thể sử dụng trực tiếp làm phân bón
- Điều chế N2H4 làm nhiên liệu cho tên lửa
- NH3 lỏng dùng làm chất làm lạnh cho thiết bị lạnh
- Sử dụng trong công nghiệp đông lạnh (sản xuất nước đá, bảo quản nông phẩm...)
- Sử dụng trong công nghiệp môi trường (loại bỏ một số khí gây ô nhiễm như SO2...)
1.5. Điều chế
Trong phòng thí nghiệm
- Đun nóng muối amoni với Ca(OH)2 hay dd kiềm:
2NH4Cl + Ca(OH)2 → CaCl2+2NH3 +2H2O
- Để làm khô khí, ta cho khí NH3 có lẫn hơi nước qua bình vôi sống CaO.
- Điều chế nhanh 1 lượng nhỏ khí NH3, ta đun nóng dung dịch NH3 đậm đặc.
Trong công nghiệp
N2 + 3H2 ⇔ 2NH3 (đk: 450 - 500oC), Fe, 200-300 atm)
- Nhiệt độ: 450 – 500OC
- Áp suất: 200- 300 atm
- Chất xúc tác: Fe/Al2O3, K2O
2. MUỐI AMONI
Muối amoni là chất tinh thể ion gồm cation amoni NH4+ và anion gốc axít. Ví dụ: NH4Cl, (NH4)2SO4 , (NH4)2CO3
2.1.Tính chất vật lý
- Tinh thể
- Đều tan trong nước
- Ion NH4+ không màu
2.2.Tính chất hoá học
Tác dụng với bazơ kiềm
(NH4)2SO4 + 2NaOH → Na2SO4 + 2NH3 + 2H2O.
Phương trình ion thu gọn: NH4+ + OH- → NH3 + H2O
→ Điều chế NH3 trong Phòng thí nghiệm và nhận biết muối amoni.
Phản ứng nhiệt phân
- Muối amoni tạo bởi axít không có tính oxi hoá: (HCl,H2CO3) → NH3
NH4Cl (r) → NH3 (k) + HCl (k).
(NH4)2CO3 (r) → NH3 (k) + NH4HCO3(r).
NH4HCO3(r) → NH3(k) + CO2(k) + H2O
(NH4)2CO3; NH4HCO3 ở nhiệt độ thường cũng tự phân huỷ; ở nhiệt độ cao phản ứng xảy ra nhanh hơn; Dùng NH4HCO3 trong bột nở.
- Muối amoni tạo bởi axít có tính oxi hoá:
(HNO2, HNO3) → N2 , N2O
NH4NO2 → N2 + 2H2O
NH4NO3 → N2O + 2H2O
Bài 1:
Để nhận biết các dung dịch: NH4NO3, (NH4)2SO4, K2SO4 đựng trong các lọ mất nhãn ta dùng:
Hướng dẫn:
- Bước 1: Trích dẫn 3 mẫu thử
- Bước 2: Bari tan trong nước tạo dung dịch Ba(OH)2
+ NH4NO3: có khí mùi khai: Ba(OH)2 + 2NH4NO3 → Ba(NO3)2 + 2NH3 + 2H2O
+ (NH4)2SO4: khí mùi khai và kết tủa trắng: Ba(OH)2 + (NH4)2SO4 → BaSO4 + 2NH3 + 2H2O
+ K2SO4: kết tủa trắng: Ba(OH)2 + K2SO4 → BaSO4 + 2KOH
Bài 2:
Hỗn hợp X gồm N2 và H2 có tỉ khối so với He bằng 1,8. Đun nóng X một thời gian trong bình kín (có bột Fe làm xúc tác) thu được hỗn hợp Y có tỉ khối so với He bằng 2. Hiệu suất của phản ứng tổng hợp NH3 là:
Hướng dẫn:
MX = 7,2. Áp dụng quy tắc đường chéo ta có:
\(n_{H_2}:n_{N_2}=4:1\)
⇒ Giả sử ban đầu có 4 mol H2 và 1 mol N2 trong X
N2 + 3H2 ⇔ 2NH3
x → x → 2x
⇒ sau phản ứng: nY = 2x + (1 - x) + (4 - 3x) = 5 - 2x mol
Bảo toàn khối lượng: mX = mY
⇒ 5.7,2 = (5 - 2x).2.4
⇒ x = 0,25 mol
⇒ H% (tính theo N2) = 25%
Bài 3:
Cho các phản ứng sau:
4NH3 + 5O2 → 4NO + 6H2O (1)
NH3 + H2SO4 → NH4HSO4 (2)
2NH3 + 3CuO → 3Cu + N2 + 3H2O (3)
8NH3 + 3Cl2 → N2 + 6NH4Cl (4)
NH3 + H2S → NH4HS (5)
2NH3 + 3O2 → 2N2+ 6H2O (6)
NH3 + HCl → NH4Cl (7)
Số phản ứng trong đó NH3 không đóng vai trò là chất khử là:
Hướng dẫn:
Các phản ứng mà có sự tăng số oxi hóa của N ⇒ NH3 thể hiện tính khử. Các phản ứng không có hiện tượng trên là: 2, 5, 7.
1. AMONIAC
1.1. Cấu tạo phân tử
Hình 1: Sơ đồ cấu tạo của phân tử NH3
- Nguyên tử N liên kết với 3 nguyên tử H bằng 3 liên kết cộng hóa trị có cực.
- Nguyên tử N còn có 1 cặp e hoá trị.
- Nguyên tử N có số oxi hóa thấp nhất -3
- Phân tử có cấu tạo không đối xứng nên phân tử NH3 phân cực.
1.2. Tính chất vật lý
- Là chất khí không màu, mùi khai, xốc, nhẹ hơn không khí
- Tan nhiều trong nước, tạo thành dd có tính kiềm
Video 1: Sự hòa tan của Amoniac trong nước
- Khí NH3 tan nhiều trong nước làm giảm P trong bình và nước bị hút vào bình. Phenolphtalein chuyển thành màu hồng ⇒ NH3 có tính bazơ.
- Dung dịch NH3 đậm đặc trong phòng thí nghiệm có nồng độ 25% (N = 0,91g/cm3).
1.3. Tính chất hóa học
Tính bazơ yếu
Tác dụng với nước
- Khi hoà tan khí NH3 vào nước, 1 phần các phân tử NH3 phản ứng tạo thành dd bazơ ⇒ dd NH3 là bazơ yếu:
NH3 + H2O ⇔ NH4++ OH-
- Làm quỳ tím chuyển sang màu xanh
Tác dụng với dung dịch bazơ
- Dung dịch NH3 có khả năng làm kết tủa nhiều hidroxít kim loại
AlCl3 + 3NH3 + 3 H2O → Al(OH)3 + 3 NH4Cl
Al3++3NH3+3H2O → Al(OH)3 + 3NH4+
Tác dụng với axít
2NH3 + H2SO4 → (NH4)2SO4
NH3 (k) + HCl (k) → NH4Cl
(không màu) (ko màu) (khói trắng)
Video 2: Amoniac tác dụng với axit clohidric
Tính khử
Trong phân tử NH3, N có số oxi hóa là -3. Nitơ có các số oxi hóa là -3,0,+1,+2,+3,+4,+5. Như vậy trong các phản ứng hóa học khi có sự thay đổi số oxi hóa, số oxi hóa của N trong NH3 chỉ có thể tăng lên
→ thể hiện tính khử.
Tác dụng với oxi
Video 3: Thí nghiệm giữa NH3 và Oxi
NH3 được tạo ra từ phản ứng của NH4Cl và CaO
Khí O2 được tạo ra từ phản ứng của KClO3 và MnO2
- Hiện tượng: Que đóm đang cháy bỗng vụt tắt
- Giải thích: Khí N2 không duy trì sự cháy 4 NH3 + 3O2 → 2N2 + 6 H2O
Tác dụng với Clo
2NH3 + 3Cl2 → N2 + 6 HCl
Nếu NH3 dư : NH3 + HCl → NH4Cl (khói trắng)
* Kết luận: Amoniac có các tính chất hoá học cơ bản: tính bazơ yếu và tính khử
1.4. Ứng dụng
- Sản xuất HNO3
- Sản xuất phân đạm và dd NH3 có thể sử dụng trực tiếp làm phân bón
- Điều chế N2H4 làm nhiên liệu cho tên lửa
- NH3 lỏng dùng làm chất làm lạnh cho thiết bị lạnh
- Sử dụng trong công nghiệp đông lạnh (sản xuất nước đá, bảo quản nông phẩm...)
- Sử dụng trong công nghiệp môi trường (loại bỏ một số khí gây ô nhiễm như SO2...)
1.5. Điều chế
Trong phòng thí nghiệm
- Đun nóng muối amoni với Ca(OH)2 hay dd kiềm:
2NH4Cl + Ca(OH)2 → CaCl2+2NH3 +2H2O
- Để làm khô khí, ta cho khí NH3 có lẫn hơi nước qua bình vôi sống CaO.
- Điều chế nhanh 1 lượng nhỏ khí NH3, ta đun nóng dung dịch NH3 đậm đặc.
Trong công nghiệp
N2 + 3H2 ⇔ 2NH3 (đk: 450 - 500oC), Fe, 200-300 atm)
- Nhiệt độ: 450 – 500OC
- Áp suất: 200- 300 atm
- Chất xúc tác: Fe/Al2O3, K2O
2. MUỐI AMONI
Muối amoni là chất tinh thể ion gồm cation amoni NH4+ và anion gốc axít. Ví dụ: NH4Cl, (NH4)2SO4 , (NH4)2CO3
2.1.Tính chất vật lý
- Tinh thể
- Đều tan trong nước
- Ion NH4+ không màu
2.2.Tính chất hoá học
Tác dụng với bazơ kiềm
(NH4)2SO4 + 2NaOH → Na2SO4 + 2NH3 + 2H2O.
Phương trình ion thu gọn: NH4+ + OH- → NH3 + H2O
→ Điều chế NH3 trong Phòng thí nghiệm và nhận biết muối amoni.
Phản ứng nhiệt phân
- Muối amoni tạo bởi axít không có tính oxi hoá: (HCl,H2CO3) → NH3
NH4Cl (r) → NH3 (k) + HCl (k).
(NH4)2CO3 (r) → NH3 (k) + NH4HCO3(r).
NH4HCO3(r) → NH3(k) + CO2(k) + H2O
(NH4)2CO3; NH4HCO3 ở nhiệt độ thường cũng tự phân huỷ; ở nhiệt độ cao phản ứng xảy ra nhanh hơn; Dùng NH4HCO3 trong bột nở.
- Muối amoni tạo bởi axít có tính oxi hoá:
(HNO2, HNO3) → N2 , N2O
NH4NO2 → N2 + 2H2O
NH4NO3 → N2O + 2H2O
Bài 1:
Để nhận biết các dung dịch: NH4NO3, (NH4)2SO4, K2SO4 đựng trong các lọ mất nhãn ta dùng:
Hướng dẫn:
- Bước 1: Trích dẫn 3 mẫu thử
- Bước 2: Bari tan trong nước tạo dung dịch Ba(OH)2
+ NH4NO3: có khí mùi khai: Ba(OH)2 + 2NH4NO3 → Ba(NO3)2 + 2NH3 + 2H2O
+ (NH4)2SO4: khí mùi khai và kết tủa trắng: Ba(OH)2 + (NH4)2SO4 → BaSO4 + 2NH3 + 2H2O
+ K2SO4: kết tủa trắng: Ba(OH)2 + K2SO4 → BaSO4 + 2KOH
Bài 2:
Hỗn hợp X gồm N2 và H2 có tỉ khối so với He bằng 1,8. Đun nóng X một thời gian trong bình kín (có bột Fe làm xúc tác) thu được hỗn hợp Y có tỉ khối so với He bằng 2. Hiệu suất của phản ứng tổng hợp NH3 là:
Hướng dẫn:
MX = 7,2. Áp dụng quy tắc đường chéo ta có:
\(n_{H_2}:n_{N_2}=4:1\)
⇒ Giả sử ban đầu có 4 mol H2 và 1 mol N2 trong X
N2 + 3H2 ⇔ 2NH3
x → x → 2x
⇒ sau phản ứng: nY = 2x + (1 - x) + (4 - 3x) = 5 - 2x mol
Bảo toàn khối lượng: mX = mY
⇒ 5.7,2 = (5 - 2x).2.4
⇒ x = 0,25 mol
⇒ H% (tính theo N2) = 25%
Bài 3:
Cho các phản ứng sau:
4NH3 + 5O2 → 4NO + 6H2O (1)
NH3 + H2SO4 → NH4HSO4 (2)
2NH3 + 3CuO → 3Cu + N2 + 3H2O (3)
8NH3 + 3Cl2 → N2 + 6NH4Cl (4)
NH3 + H2S → NH4HS (5)
2NH3 + 3O2 → 2N2+ 6H2O (6)
NH3 + HCl → NH4Cl (7)
Số phản ứng trong đó NH3 không đóng vai trò là chất khử là:
Hướng dẫn:
Các phản ứng mà có sự tăng số oxi hóa của N ⇒ NH3 thể hiện tính khử. Các phản ứng không có hiện tượng trên là: 2, 5, 7.