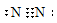Bài 7: Nitơ
1. Vị trí và cấu hình electron nguyên tử
- Vị trí nitơ: ô thứ 7, chu kỳ 2, nhóm VA.
- Cấu hình e: 1s22s22p3
- Cấu tạo phân tử nitơ:
+ CTPT: N2.
+ Công thức electron:
+ CTCT: N≡N
⇒ 2 nguyên tử trong phân tử nitơ có 3 liên kết cộng hóa trị không cực.
2. Tính chất vật lí
Ở đk thường:
- Là chất khí không màu, không mùi, không vị.
- dN2/ kk = 28/29 ⇒ hơi nhẹ hơn kk.
- Hóa lỏng ở -1960C, hóa rắn ở -2100C.
- Rất ít tan trong nước.
- Không duy trì sự cháy và sự sống.
3. Tính chất hóa học
- Nitơ là phi kim khá hoạt động (độ âm điện = 3), nhưng ở nhiệt độ thường khá trơ về mặt hóa học. Do 2 nguyên tử N liên kết với nhau bằng 1liên kết ba không phân cực nên rất bền do năng lượng liên kết lớn, nên nitơ khá trơ về mặt hóa học ở nhiệt độ thường.
- Số oxi hóa của nitơ trong hợp chất với hidro, kim loại là -3, trong hợp chất với oxi, flo là từ +1 → +5.
- Tùy thuộc vào sự thay đổi số oxi hóa, nitơ có thể thể hiện tính khử hay tính oxi hóa. (chủ yếu là tính oxi hóa).
a. Tính oxi hóa
* Tác dụng với kim loại: (kim loại mạnh như Li, Na, K, Mg, Ba...)
- Liti là kim loại duy nhất tác dụng được với Nitơ ở nhiệt độ thường: 6Li + N2 → 2Li3N (Liti nitrua)
- Ở nhiệt độ cao, Nitơ tác dụng được với một số kim loại hoạt động như Ca, Mg, Al tạo nitrua kim loại:
3Mg + N2 → Mg3N2 (Magie nitrua)
*Tác dụng với hidro: 3H2 + N2 ⇔ 2NH3 (đk: 450oC, xt Fe)
b. Tính khử

Hình 1: Sấm chớp cung cấp năng lượng cho phản ứng giữa Nito và Oxi
- ở nhiệt độ khoảng 30000C (hoặc hồ quang điện, hoặc tia lửa điện hình thành sấm sét) đã cung cấp năng lượng cho phản ứng nitơ kết hợp trực tiếp với O2 tạo nitơ monoxit NO
N2 + O2 ⇔ 2NO (xt: hồ quang điện)
- NO kết hợp dễ dàng với oxi: 2NO + O2 ⇔ 2NO2
- Một số oxit khác của nitơ như: N2O, N2O3, N2O5 chúng ko điều chế trực tiếp từ nitơ và oxi.
* Kết luận: N2 thể hiện tính khử khi td với nguyên tố có độ âm điện lớn hơn (như O2), thể hiện tính oxi hóa khi tác dụng với nguyên tố có độ âm điện nhỏ hơn như (kim loại mạnh, H2).
4. Ứng dụng
- Là thành phần cấu tạo nên protêin, thành phần dinh dưỡng chính của thực vật. N2 có nhiệt độ sôi thấp nên dùng làm lạnh trong công nghiệp và trong phòng thí nghiệm.
- Công nghiệp:
+ Tổng hợp NH3, sản xuất HNO3, phân đạm…
+ Môi trường trơ trong luyện kim, thực phẩm, điện tử…
- Y tế: N2 lỏng: bảo quản mẫu máu, các mẫu vật sinh học khác…
+ Dựa vào tính trơ của nitơ mà bảo quan tranh vẽ trong viện bảo tàng chứa đầy khí nitơ trong ống của cuộn tranh tránh các phân tử khác bị oxi hóa hư màu vẽ.
+ Bơm vào bóng đèn điện để giảm sự bốc hơi kim loại trên bề mặt dây tóc.
+ Bơm nitơ vào phổi bệnh nhân lao để ép lá phổi cho nó nghỉ ngơi…
5. Trạng thái tự nhiên
Hình 2: Phần trăm mỗi đồng vị của Nito
- Ở dạng hợp chất, nitơ có nhiều trong khoáng chất natri nitrat NaNO3 với tên gọi là diêm tiêu natri
6. Điều chế
a. Trong công nghiệp
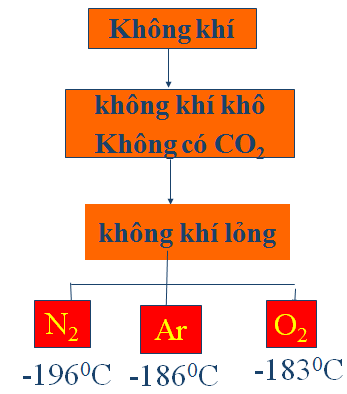
Hình 3: Chưng cất phân đoạn không khí lỏng
b. Trong phòng thí nghiệm
NH4NO2 → N2 + 2H2O
NH4Cl + NaNO2 → NaCl + N2 + 2H2O
Bài 1:
Hãy nêu số oxi hóa của nitơ các chất sau: NH3, Mg3N2, N2, N2O, NO, NF3, NO2, HNO3. Nhận xét số oxi hóa của nitơ trong hợp chất với hidro, kim loại và trong hợp chất với oxi, flo?
Hướng dẫn:
- Số oxi hóa của N ở các chất NH3, Mg3N2, N2, N2O, NO, NF3, NO2, HNO3 lần lượt là: (-3), (-3), (0), (+1), (+2), (+3), (+4), (+5)
- Số oxi hóa của nitơ trong hợp chất với hidro, kim loại là -3, trong hợp chất với oxi, flo là từ +1 → +5.
1. Vị trí và cấu hình electron nguyên tử
- Vị trí nitơ: ô thứ 7, chu kỳ 2, nhóm VA.
- Cấu hình e: 1s22s22p3
- Cấu tạo phân tử nitơ:
+ CTPT: N2.
+ Công thức electron:
+ CTCT: N≡N
⇒ 2 nguyên tử trong phân tử nitơ có 3 liên kết cộng hóa trị không cực.
2. Tính chất vật lí
Ở đk thường:
- Là chất khí không màu, không mùi, không vị.
- dN2/ kk = 28/29 ⇒ hơi nhẹ hơn kk.
- Hóa lỏng ở -1960C, hóa rắn ở -2100C.
- Rất ít tan trong nước.
- Không duy trì sự cháy và sự sống.
3. Tính chất hóa học
- Nitơ là phi kim khá hoạt động (độ âm điện = 3), nhưng ở nhiệt độ thường khá trơ về mặt hóa học. Do 2 nguyên tử N liên kết với nhau bằng 1liên kết ba không phân cực nên rất bền do năng lượng liên kết lớn, nên nitơ khá trơ về mặt hóa học ở nhiệt độ thường.
- Số oxi hóa của nitơ trong hợp chất với hidro, kim loại là -3, trong hợp chất với oxi, flo là từ +1 → +5.
- Tùy thuộc vào sự thay đổi số oxi hóa, nitơ có thể thể hiện tính khử hay tính oxi hóa. (chủ yếu là tính oxi hóa).
a. Tính oxi hóa
* Tác dụng với kim loại: (kim loại mạnh như Li, Na, K, Mg, Ba...)
- Liti là kim loại duy nhất tác dụng được với Nitơ ở nhiệt độ thường: 6Li + N2 → 2Li3N (Liti nitrua)
- Ở nhiệt độ cao, Nitơ tác dụng được với một số kim loại hoạt động như Ca, Mg, Al tạo nitrua kim loại:
3Mg + N2 → Mg3N2 (Magie nitrua)
*Tác dụng với hidro: 3H2 + N2 ⇔ 2NH3 (đk: 450oC, xt Fe)
b. Tính khử

Hình 1: Sấm chớp cung cấp năng lượng cho phản ứng giữa Nito và Oxi
- ở nhiệt độ khoảng 30000C (hoặc hồ quang điện, hoặc tia lửa điện hình thành sấm sét) đã cung cấp năng lượng cho phản ứng nitơ kết hợp trực tiếp với O2 tạo nitơ monoxit NO
N2 + O2 ⇔ 2NO (xt: hồ quang điện)
- NO kết hợp dễ dàng với oxi: 2NO + O2 ⇔ 2NO2
- Một số oxit khác của nitơ như: N2O, N2O3, N2O5 chúng ko điều chế trực tiếp từ nitơ và oxi.
* Kết luận: N2 thể hiện tính khử khi td với nguyên tố có độ âm điện lớn hơn (như O2), thể hiện tính oxi hóa khi tác dụng với nguyên tố có độ âm điện nhỏ hơn như (kim loại mạnh, H2).
4. Ứng dụng
- Là thành phần cấu tạo nên protêin, thành phần dinh dưỡng chính của thực vật. N2 có nhiệt độ sôi thấp nên dùng làm lạnh trong công nghiệp và trong phòng thí nghiệm.
- Công nghiệp:
+ Tổng hợp NH3, sản xuất HNO3, phân đạm…
+ Môi trường trơ trong luyện kim, thực phẩm, điện tử…
- Y tế: N2 lỏng: bảo quản mẫu máu, các mẫu vật sinh học khác…
+ Dựa vào tính trơ của nitơ mà bảo quan tranh vẽ trong viện bảo tàng chứa đầy khí nitơ trong ống của cuộn tranh tránh các phân tử khác bị oxi hóa hư màu vẽ.
+ Bơm vào bóng đèn điện để giảm sự bốc hơi kim loại trên bề mặt dây tóc.
+ Bơm nitơ vào phổi bệnh nhân lao để ép lá phổi cho nó nghỉ ngơi…
5. Trạng thái tự nhiên
Hình 2: Phần trăm mỗi đồng vị của Nito
- Ở dạng hợp chất, nitơ có nhiều trong khoáng chất natri nitrat NaNO3 với tên gọi là diêm tiêu natri
6. Điều chế
a. Trong công nghiệp
Hình 3: Chưng cất phân đoạn không khí lỏng
b. Trong phòng thí nghiệm
NH4NO2 → N2 + 2H2O
NH4Cl + NaNO2 → NaCl + N2 + 2H2O
Bài 1:
Hãy nêu số oxi hóa của nitơ các chất sau: NH3, Mg3N2, N2, N2O, NO, NF3, NO2, HNO3. Nhận xét số oxi hóa của nitơ trong hợp chất với hidro, kim loại và trong hợp chất với oxi, flo?
Hướng dẫn:
- Số oxi hóa của N ở các chất NH3, Mg3N2, N2, N2O, NO, NF3, NO2, HNO3 lần lượt là: (-3), (-3), (0), (+1), (+2), (+3), (+4), (+5)
- Số oxi hóa của nitơ trong hợp chất với hidro, kim loại là -3, trong hợp chất với oxi, flo là từ +1 → +5.