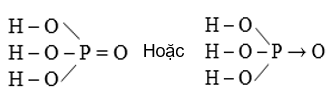Bài 11: Axit photphoric và muối photphat
1. Axit photphoric
1.1. Cấu tạo phân tử
Hình 1: Cấu tạo phân tử H3PO4
- Photpho có số oxi hóa là +5
1.2. Tính chất vật lí
- Tinh thể trong suốt, nóng chảy ở 42,50C. Rất háo nước nên dễ chảy rữa, tan trong nước ở bất kì tỉ lệ nào.
- Dung dịch axit sunfuric là dung dịch đặc, sánh, không màu, có nồng độ 85%.
1.3. Tính chất hóa học
1.3.1. Tính axít
- Trong nước H3PO4 phân li theo 3 nấc:
H3PO4 ⇔ H+ + H2PO4-
H2PO4- ⇔ H+ + HPO42-
HPO42- ⇔ H+ + PO43-
- Dung dịch H3PO4 có tính chất chung của 1 axít và có độ mạnh TB: Nấc 1 > nấc 2 > nấc 3
1.3.2. Tác dụng với bazơ
- Tuỳ theo tỉ lệ chất tham gia phản ứng mà H3PO4 sinh ra muối axít hoặc muối trung hoà
H3PO4 + NaOH → NaH2PO4 + H2O (1)
H3PO4 + 2 NaOH → Na2HPO4+ 2H2O (2)
H3PO4 + 3 NaOH → Na3PO4 + 3H2O (3)
- \(a = \frac{{{n_{NaOH}}}}{{{n_{{H_3}P{O_4}}}}}\)
Nếu a \( \le \) 1 → NaH2PO4 (1)
Nếu a = 2 → Na2HPO4 (2)
Nếu a \(\geq\) 3 → Na3PO4 (3)
Nếu 1< a < 2 xảy ra (1) và (2)
Nếu 2< a < 3 xảy ra (2) và (3)
1.3.3. H3PO4 không có tính oxi hóa
- Mặc dù Photpho có số oxi hóa cao nhất +5 nhưng H3PO4 không có tính oxi hoá như HNO3 vì trong ion PO43- rất bền vững.
- H3PO4 là axít 3 nấc có độ mạnh trung bình và không có tính oxi hoá.
1.4. Điều chế
- Từ quặng photphorit hoặc apatit:
Ca3(PO4)2 + 3 H2SO4 (đ) → 2H3PO4 + 3CaSO4
→ H3PO4 thu được không tinh khiết.
- Từ photpho:
4P + 5O2 → 2P2O5
P2O5 + 3 H2O → 2 H3PO4
→ Phương pháp này H3PO4 có độ tinh khiết và nồng độ cao hơn.
1.5. Ứng dụng
- Điều chế muối photphat
- Sản xuất phân lân, thuốc trừ sâu
- Dược phẩm
2. Muối photphat
2.1. Tính tan
- Muối trung hoà và muối axit của kim loại Na, K đều tan trong nước
- Với các kim loại khác: Chỉ muối đihiđrophotphat tan, còn lại đều không tan hoặc ít tan
2.2. Nhận biết ion photphat
- Thuốc thử: Dung dịch AgNO3
- Hiện tượng: Kết tủa màu vàng
- Phương trình hóa học: 3Ag+ + PO4 3- → Ag3PO4 (màu vàng)
Video 2: Nhận biết ion photphat
Bài 1:
Chia dung dịch H3PO4 thành 3 phần bằng nhau:
Trung hoà phần một vừa đủ bởi 300ml dung dịch NaOH 1,5M.
Trộn phần hai với phần ba rồi cho tiếp vào một lượng dung dịch NaOH như đã dùng ở phần một, cô cạn dung dịch sau phản ứng thu được m gam muối. Giá trị m là:
Hướng dẫn:
P1: 1/3.nNaOH = nH3PO4 = 0,15 mol
P2 + P3: nH3PO4 = 0,3 mol
→ nNaOH = 1,5.nH3PO4
⇒ Tạo muối: NaH2PO4: x mol và Na2HPO4: y mol
⇒ nNaOH = x + 2y = 0,45; x + y = 0,3
⇒ x = y = 0,15 mol
⇒ Muối gồm 0,15 mol NaH2PO4 và 0,15 mol Na2HPO4
⇒ m = 39,3g
Bài 2:
Cho sơ đồ phản ứng sau: Ca3(PO4)2 → P → P2O5 → H3PO4. Để điều chế được 5 lít H3PO4 2M cần dùng hết bao nhiêu kg quặng photphorit? Biết hiệu suất của cả quá trình là 80%, hàm lượng Ca3(PO4)2 trong quặng chiếm 95%.
Hướng dẫn:
Giả sử cần mg quặng
⇒ mCa3(PO4)2 = 0,95m gam
⇒ Thực tế chỉ có 0,8.0,95m = 0,76m (g) Ca3(PO4)2 phản ứng
Ca3(PO4)2 → 2H3PO4
310g 2.98g
0,76m(g) 980g
⇒ m = 2040g = 2,04 kg
Bài 3:
Cho H3PO4 tác dụng hết với dung dịch chứa m gam NaOH, sau phản ứng thu được dung dịch X có chứa 2,51m gam chất tan. Các chất tan trong dung dịch X là:
Hướng dẫn:
Các phản ứng có thể xảy ra:
(1) 3NaOH + H3PO4 → Na3PO4 + 3H2O
(2) 2NaOH + H3PO4 → Na2HPO4 + 2H2O
(3) NaOH + H3PO4 → NaH2PO4 + H2O
Ta thấy: nNaOH = nH2O = 0,025m mol
Bảo toàn khối lượng:
mH3PO4 + mNaOH = m chất tan + mH2O
→ mH3PO4 = 1,62m gam⇒ nH3PO4 = 0,016m mol
→ nNaOH : nH3PO4 = 0,025m : 0,016m = 1,52 (1 < 1,52 < 2)
⇒ Xảy ra phản ứng (2) và (3)
Chất tan là Na2HPO4 và NaH2PO4
1. Axit photphoric
1.1. Cấu tạo phân tử
Hình 1: Cấu tạo phân tử H3PO4
- Photpho có số oxi hóa là +5
1.2. Tính chất vật lí
- Tinh thể trong suốt, nóng chảy ở 42,50C. Rất háo nước nên dễ chảy rữa, tan trong nước ở bất kì tỉ lệ nào.
- Dung dịch axit sunfuric là dung dịch đặc, sánh, không màu, có nồng độ 85%.
1.3. Tính chất hóa học
1.3.1. Tính axít
- Trong nước H3PO4 phân li theo 3 nấc:
H3PO4 ⇔ H+ + H2PO4-
H2PO4- ⇔ H+ + HPO42-
HPO42- ⇔ H+ + PO43-
- Dung dịch H3PO4 có tính chất chung của 1 axít và có độ mạnh TB: Nấc 1 > nấc 2 > nấc 3
1.3.2. Tác dụng với bazơ
- Tuỳ theo tỉ lệ chất tham gia phản ứng mà H3PO4 sinh ra muối axít hoặc muối trung hoà
H3PO4 + NaOH → NaH2PO4 + H2O (1)
H3PO4 + 2 NaOH → Na2HPO4+ 2H2O (2)
H3PO4 + 3 NaOH → Na3PO4 + 3H2O (3)
- \(a = \frac{{{n_{NaOH}}}}{{{n_{{H_3}P{O_4}}}}}\)
Nếu a \( \le \) 1 → NaH2PO4 (1)
Nếu a = 2 → Na2HPO4 (2)
Nếu a \(\geq\) 3 → Na3PO4 (3)
Nếu 1< a < 2 xảy ra (1) và (2)
Nếu 2< a < 3 xảy ra (2) và (3)
1.3.3. H3PO4 không có tính oxi hóa
- Mặc dù Photpho có số oxi hóa cao nhất +5 nhưng H3PO4 không có tính oxi hoá như HNO3 vì trong ion PO43- rất bền vững.
- H3PO4 là axít 3 nấc có độ mạnh trung bình và không có tính oxi hoá.
1.4. Điều chế
- Từ quặng photphorit hoặc apatit:
Ca3(PO4)2 + 3 H2SO4 (đ) → 2H3PO4 + 3CaSO4
→ H3PO4 thu được không tinh khiết.
- Từ photpho:
4P + 5O2 → 2P2O5
P2O5 + 3 H2O → 2 H3PO4
→ Phương pháp này H3PO4 có độ tinh khiết và nồng độ cao hơn.
1.5. Ứng dụng
- Điều chế muối photphat
- Sản xuất phân lân, thuốc trừ sâu
- Dược phẩm
2. Muối photphat
2.1. Tính tan
- Muối trung hoà và muối axit của kim loại Na, K đều tan trong nước
- Với các kim loại khác: Chỉ muối đihiđrophotphat tan, còn lại đều không tan hoặc ít tan
2.2. Nhận biết ion photphat
- Thuốc thử: Dung dịch AgNO3
- Hiện tượng: Kết tủa màu vàng
- Phương trình hóa học: 3Ag+ + PO4 3- → Ag3PO4 (màu vàng)
Video 2: Nhận biết ion photphat
Bài 1:
Chia dung dịch H3PO4 thành 3 phần bằng nhau:
Trung hoà phần một vừa đủ bởi 300ml dung dịch NaOH 1,5M.
Trộn phần hai với phần ba rồi cho tiếp vào một lượng dung dịch NaOH như đã dùng ở phần một, cô cạn dung dịch sau phản ứng thu được m gam muối. Giá trị m là:
Hướng dẫn:
P1: 1/3.nNaOH = nH3PO4 = 0,15 mol
P2 + P3: nH3PO4 = 0,3 mol
→ nNaOH = 1,5.nH3PO4
⇒ Tạo muối: NaH2PO4: x mol và Na2HPO4: y mol
⇒ nNaOH = x + 2y = 0,45; x + y = 0,3
⇒ x = y = 0,15 mol
⇒ Muối gồm 0,15 mol NaH2PO4 và 0,15 mol Na2HPO4
⇒ m = 39,3g
Bài 2:
Cho sơ đồ phản ứng sau: Ca3(PO4)2 → P → P2O5 → H3PO4. Để điều chế được 5 lít H3PO4 2M cần dùng hết bao nhiêu kg quặng photphorit? Biết hiệu suất của cả quá trình là 80%, hàm lượng Ca3(PO4)2 trong quặng chiếm 95%.
Hướng dẫn:
Giả sử cần mg quặng
⇒ mCa3(PO4)2 = 0,95m gam
⇒ Thực tế chỉ có 0,8.0,95m = 0,76m (g) Ca3(PO4)2 phản ứng
Ca3(PO4)2 → 2H3PO4
310g 2.98g
0,76m(g) 980g
⇒ m = 2040g = 2,04 kg
Bài 3:
Cho H3PO4 tác dụng hết với dung dịch chứa m gam NaOH, sau phản ứng thu được dung dịch X có chứa 2,51m gam chất tan. Các chất tan trong dung dịch X là:
Hướng dẫn:
Các phản ứng có thể xảy ra:
(1) 3NaOH + H3PO4 → Na3PO4 + 3H2O
(2) 2NaOH + H3PO4 → Na2HPO4 + 2H2O
(3) NaOH + H3PO4 → NaH2PO4 + H2O
Ta thấy: nNaOH = nH2O = 0,025m mol
Bảo toàn khối lượng:
mH3PO4 + mNaOH = m chất tan + mH2O
→ mH3PO4 = 1,62m gam⇒ nH3PO4 = 0,016m mol
→ nNaOH : nH3PO4 = 0,025m : 0,016m = 1,52 (1 < 1,52 < 2)
⇒ Xảy ra phản ứng (2) và (3)
Chất tan là Na2HPO4 và NaH2PO4