Đề thi khảo sát chất lượng học kì 1 môn Hóa học 10 trường THPT Ngô Sĩ Liên năm học 2021-2022
Đề thi khảo sát chất lượng học kì 1 môn Hóa học 10 trường THPT Ngô Sĩ Liên năm học 2021-2022 là bộ tài liệu hay và chất lượng được Tìm Đáp Án sưu tầm và đăng tải từ các trường THCS trên cả nước, nhằm cung cấp cho các bạn nguồn tư liệu hữu ích để ôn thi học kì 1 sắp tới. Bộ tài liệu này bám sát nội dụng nằm trong chương trình học môn Hóa học 10 học kì 1 giúp các bạn học sinh ôn luyện củng cố, bổ sung thêm kiến thức, các dạng bài tập qua đó trong kì thi học kì tới đạt kết quả cao. Thầy cô có thể tham khảo bộ tài liệu này để ra câu hỏi trong quá trình ra đề thi. Mời thầy cô cùng các bạn tham khảo chi tiết đề thi.
SỞ GD&ĐT BẮC GIANG TRƯỜNG THPT NGÔ SĨ LIÊN
| ĐỀ THI THÁNG LẦN 1 Năm học: 2021- 2022 Môn thi: Hóa học 10 Thời gian làm bài: 90 phút ( Không kể thời gian phát đề) |
Mã đề thi: 132
* Cho biết nguyên tử khối của các nguyên tố: H = 1; C = 12; N = 14; O = 16; Na = 23; Mg = 24; Al = 27; S = 32; Cl = 35,5; K = 39, Fe = 56; Cu = 64; Ba = 137, Ca = 40.
A. PHẦN TRẮC NGHIỆM
Câu 1: Điều khẳng định nào sau đây là sai ?
A. Số khối A là tổng số proton (Z) và tổng số nơtron (N).
B. Nguyên tử được cấu tạo nên bởi các hạt proton, electron, nơtron.
C. Trong nguyên tử số hạt proton bằng số hạt electron.
D. Hạt nhân nguyên tử được cấu tạo nên bởi các hạt proton, electron, nơtron.
Câu 2: Công thức phân tử của hợp chất khí tạo bởi nguyên tố R và hiđro là RH3. Trong oxit mà R có hoá trị cao nhất thì oxi chiếm 74,07% về khối lượng. Nguyên tố R là
A. S. B. P. C. N. D. As.
Câu 3: Khi cho 0,6g một kim loại thuộc nhóm IIA tác dụng với nước thì thu được 0,336lit H2 (đktc). Kim loại đó là:
` A. Zn B. Mg C. Ý kiến khác D. Ca
Câu 4: Một nguyên tử được đặc trưng cơ bản bằng
A. Số khối A và số nơtron B. Số proton và điện tích hạt nhân
C. Số proton và số electron D. Số khối A và điện tích hạt nhân
Câu 5: Trong 1 chu kì, đi từ trái sang phải, theo chiều Z tăng dần, bán kính nguyên tử:
A. Tăng dần B. Giảm dần C. Không đổi D. Không xác định
Câu 6: Xét 3 nguyên tố có cấu hình electron lần lượt là:
(X) 1s22s22p63s1 (Y) 1s22s22p63s2 (Z) 1s22s22p63s23p1
Hiđroxit của X, Y, Z xếp theo thứ tự tính bazơ tăng dần:
A. XOH < Y(OH)2 < Z(OH)3 B. X(OH)2 < Z(OH)3 < XOH
C. Z(OH)3 < Y(OH)2 < XOH D. Z(OH)2 < XOH < Y(OH)2
Câu 7: Nguyên tử X có tổng số hạt p,n,e là 52 và số khối là 35. Cấu hình electron của X là
A. 1s22s22p63s23p4.
B. 1s2 2s2 2p6 3s2 3p64s23d105s24p3.
C. 1s22s22p63s23p6.
D. 1s2 2s2 2p6 3s2 3p5 .
Câu 8: Cho biết cấu hình electron của các nguyên tố X : 1s22s22p63s23p4 ; Y : 1s22s22p63s23p64s2 ; Z : 1s22s22p63s23p6. Nguyên tố nào là kim loại ?
A. X B. Y C. Z D. X và Y
Câu 9: Nguyên tố Bo có 2 đồng vị 11B (x1%) và 10B (x2%), ngtử khối trung bình của Bo là 10,8. Giá trị của x1% là:
A. 80% B. 20% C. 10,8% D. 89,2%
Câu 10: Định nghĩa về đồng vị nào sau đây đúng:
A. Đồng vị là tập hợp các nguyên tử có cùng số nơtron, khác nhau số prôton.
B. Đồng vị là tập hợp các nguyên tố có cùng số nơtron, khác nhau số prôton
C. Đồng vị là tập hợp các nguyên tử có cùng số prôton, khác nhau số nơtron
D. Đồng vị là tập hợp các nguyên tố có cùng số proton, khác nhau số nơtron
Câu 11: Một ngtử X có tổng số e ở các phân lớp p là 8. Hãy cho biết X thuộc về nguyên tố hoá học nào sau đây?
A. nguyên tố B. D. nguyên tố f. C. nguyên tố p. D. nguyên tố s.
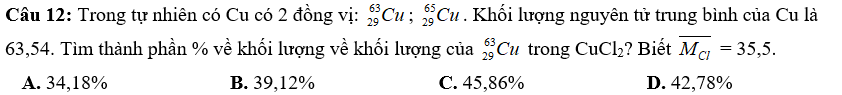
Câu 13: Trong phân tử M2X có tổng số hạt p,n,e là 140, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 44 hạt. Số khối của M lớn hơn số khối của X là 23. Tổng số hạt p,n,e trong nguyên tử M nhiều hơn trong nguyên tử X là 34 hạt. CTPT của M2X là:
A. Na2O B. Li2O C. K2O D. Rb2O
Câu 14: Nguyên tử của nguyên tố X có cấu hình Electron là: 1s22s22p63s23p5. Vị trí của X trong bảng tuần hoàn?
A. Chu kỳ 3, nhóm VIIA .
B. Chu kỳ 4, nhóm VIIA .
C. Chu kỳ 3, nhóm IA .
D. Chu kỳ 2, nhóm IIIA.
Câu 15: Nguyên tử của nguyên tố X có tổng số hạt là 40 .Tổng số hạt mang điện nhiều hơn tổng số hạt không mang điện là 12 hạt .Nguyên tố X có số khối là :
A. 28 B. 27 C. 26 D. 23
Câu 16: The electron configuration of a sulfur element (Z=16) is
A. 1s22s22p63s23p4. B. 1s22s22p63s1. C. 1s22s22p63s2. D. 1s22s22p43s1.
Câu 17: Nguyên tử X có tổng số hạt p, n, e là 28 hạt. Kí hiệu nguyên tử của X là

Câu 18: Nitơ trong thiên nhiên là hỗn hợp gồm hai đồng vị là  (99,63%) và
(99,63%) và  (0,37%). Nguyên tử khối trung bình của nitơ là
(0,37%). Nguyên tử khối trung bình của nitơ là
A. 14,7 B. 13,7 C. 14,0 D. 14,4
Câu 19: Nguyên tử của nguyên tố R có 3 lớp e, lớp ngoài cùng có 5e. Vậy số hiệu nguyên tử của nguyên tố R là
A. 15. B. 16. C. 14. D. 13.
Câu 20: Nguyên tố hóa học bao gồm các nguyên tử:
A. Có cùng điện tích hạt nhân B. Có cùng số nơtron
C. Có cùng số khối A D. Có cùng số proton và số nơtron
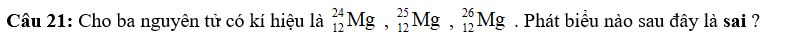
A. Số hạt electron của các nguyên tử lần lượt là: 12, 13, 14
B. Hạt nhân của mỗi ngtử đều có 12 proton.
C. Đây là 3 đồng vị.
D. Ba nguyên tử trên đều thuộc nguyên tố Mg.
Câu 22: Một nguyên tử X có 3 lớp. Ở trạng thái cơ bản, số electron tối đa trong lớp M là:
A. 2 B. 8 C. 18 D. 32
Câu 23: Hầu hết các nguyên tử được tạo nên từ hạt
A. electron và proton. B. electron, proton và nơtron .
C. electron và nơtron. D. proton và nơtron.
Câu 24: Tính kim loại tăng dần trong dãy :
A. Na, K, Al, Mg B. Al, Mg, Na, K C. K, Mg, Al, Na D. Al, Mg, K, Na
Câu 25: Trong tự nhiên H có 3 đồng vị: 1H, 2H, 3H. Oxi có 3 đồng vị 16O, 17O, 18O. Hỏi có bao nhiêu loại phân tử H2O được tạo thành từ các loại đồng vị trên:
A. 18 B. 3 C. 9 D. 16
Câu 26: Nguyên tố M ở chu kỳ 4 nhóm VIIIB. Vậy, nguyên tử của nguyên tố M có cấu hình Electron là:
A. [Ar] 3d5 4s1. B. [Ar] 3d104s1. C. [Ar] 4s1. D. [Ar] 3d6 4s2.
Câu 27: Chọn câu phát biểu sai:
A. Số p bằng số e
B. Tổng số p và số e được gọi là số khối
C. Trong 1 nguyên tử số p = số e = điện tích hạt nhân
D. Số khối bằng tổng số hạt p và n
Câu 28: Khối lượng riêng của canxi kim loại là 1,55 g/cm3. Giả thiết rằng, trong tinh thể canxi các nguyêntử là những hình cầu chiếm 74% thể tích tinh thể, phần còn lại là khe rỗng.( MCa = 40) Bán kính nguyên tử canxi là
A. 0,185 nm. B. 0,196 nm. C. 0,155 nm. D. 0,168 nm.
Câu 29: Hạt nhân của hầu hết các nguyên tử do các loại hạt sau cấu tạo nên
A. electron và nơtron B. electron và proton
C. electron, proton và nơtron D. proton và nơtron
Câu 30: Dãy các nguyên tố sắp xếp theo chiềutăng dần tính phi kim từ trái sang phải là:
A. P, N, F, O. B. N, P, F, O. C. P, N, O, F. D. N, P, O, F.
B. PHẦN TỰ LUẬN
Bài 1. Nguyên tử của nguyên tố R có phân mức năng lượng cao nhất là 4s1.
a, Viết cấu hình electron của R.
b, Xác định vị trí của R trong bảng tuần hoàn.
c, Viết phản ứng hóa học khi cho R và oxit của nó tác dụng với nước.
Bài 2. Nguyên tố X thuộc chu kì 3, nhóm VIA.
a, X là kim loại hay phi kim. Vì sao?
b, Viết công thức oxit và hidroxit của X.( cho X có hóa trị cao nhất)
Bài 3: Nguyên tố X có hoá trị 1 trong hợp chất khí với hiđro. Trong hợp chất oxit cao nhất X chiếm 38,8% khối lượng. Tìm X.
Bài 4: Cho 11,2 g hỗn hợp 2 kim loại A và B đều có hóa trị I ở 2 chu kì liên tiếp vào dd 200 ml H2O
được 4,48 lít khí (đktc) và dd E. Cho DH2O = 1g/ml.
a. Xác định A, B ?
b. Tính C% các chất trong dd E ?
Bài 5. Cho 16 gam hỗn hợp X chứa Mg và kim loại M vào dung dịch HCl dư, sau khi phản ứng kết thúc thu được 8,96 lít khí H2 (đktc). Cũng 16 gam hỗn hợp X ở trên tan hoàn toàn trong dung dịch H2SO4 đặc nóng dư thu được dung dịch Y và 11,2 lít khí SO2 (đktc) duy nhất. Viết phương trình hóa học xảy ra và xác định kim loại M.
----------- HẾT ----------
Thí sinh không được sử dụng tài liệu. Cán bộ coi thi không giải thích gì thêm.
Họ và tên thí sinh:…………………………………….Số báo danh:…………………….
Ngoài Đề thi khảo sát chất lượng học kì 1 môn Hóa học 10 trường THPT Ngô Sĩ Liên năm học 2021-2022 trên, các bạn có thể tham khảo thêm nhiều Bộ đề thi mới nhất như môn Toán 10, Ngữ văn 10, Tiếng Anh 10, Vật lý 10, Hóa học 10, Sinh học 10…., Sách giáo khoa lớp 10, Sách điện tử lớp 10, Tài liệu hay, chất lượng và một số kinh nghiệm kiến thức đời sống thường ngày khác mà Tìm Đáp Án đã sưu tầm và đăng tải. Chúc các bạn ôn luyện đạt được kết quả tốt!











