Đề thi học sinh giỏi môn Hóa học lớp 9
Đề thi chọn học sinh giỏi môn Hóa học lớp 9 trường THCS Xuân Dương năm 2014 - 2015 có 5 câu hỏi, làm trong thời gian 150 phút. Đề thi có đáp án đi kèm giúp các bạn học sinh có thể kiểm tra lại kết quả một cách linh hoạt, mời các bạn tham khảo.
Đề thi chọn học sinh giỏi môn Hóa học lớp 9 huyện Vĩnh Tường, tỉnh Vĩnh Phúc năm 2013 - 2014
Đề thi học sinh giỏi môn Hóa học lớp 9 trường THCS Hào Phú, Tuyên Quang năm học 2016 - 2017
Đề thi học sinh giỏi môn Hóa học lớp 9 Phòng GD&ĐT Phù Ninh, Phú Thọ năm học 2016 - 2017
Đề thi học sinh giỏi môn Hóa học lớp 9 Phòng GD&ĐT Quan Sơn, Thanh Hóa năm học 2016 - 2017
|
PHÒNG GIÁO DỤC VÀ ĐÀO TẠO THANH OAI TRƯỜNG THCS XUÂN DƯƠNG |
ĐỀ THI HỌC SINH GIỎI HÓA HỌC 9 NĂM HỌC 2014- 2015 Thời gian làm bài 150 phút (không tính thời gian phát đề) |
Câu I: (3 điểm)
1. Cho biết tổng số hạt proton, notron, electron trong 2 nguyên tử của nguyên tố A và B là 78, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 26 hạt. Số hạt mang điện của A nhiều hơn số hạt mang điện của B là 28 hạt. Hỏi A và B là nguyên tố gì ?
2.Chỉ được dùng thêm quì tím và ống nghiệm, hãy nêu cách nhận biết các dung dịch đựng trong các lọ mất nhãn: NaHSO4; Na2CO3; BaCl2; KOH; MgCl2
Câu II: (5 điểm)
1. Chỉ dùng một hoá chất duy nhất, hãy tách:
a. Tách FeO ra khỏi hỗn hợp FeO, Cu, Fe
b. Ag2O ra khỏi hổn hợp Ag2O, SiO2, Al2O3
2. Cho đá vôi tác dụng với dung dịch axit HCl thu được 26,88l CO2 (đo ở đktc). Dẫn toàn bộ lựợng CO2 thu được vào 1 lít dung dịch NaOH 5%. Tính khối lượng muối tạo thành biết khối lượng riêng của NaOH là 1,28g/ml.
Câu III: (5 điểm)
1. Cho 0,15 mol muối của một kim loại hóa trị II và axit có một nguyên tử Hiđro tác dụng dừa đủ với dung dịch NaOH thu được 8,7g kết tủa và phần còn lại có khối lượng 17,55 g. Xác định công thức hóa học của muối trên.
2. Hỗn hợp Mg, Fe có khối lương m gam được hòa tan hoàn toàn bởi dung dịch HCl. Dung dịch thu được hòa tan vào dung dịch NaOH dư. Kết tủa sinh ra sau phản ứng đem nung trong không khí đến khối lượng không đổi khối lượng giảm a gam so với trước khi nung.
a/ Xác định thành phần% khối lượng mỗi kim loại theo m, a
b/ Áp dụng với m = 8g, a = 2,8g
Câu IV: (3 điểm)
1. Hỗn hợp A gồm BaO, FeO, Al2O3. Hoà tan A trong lượng nước dư được dung dịch D và phần không tan B. Sục khí CO2 dư vào D, phản ứng tạo kết tủa. Cho khí CO dư qua B nung nóng được chất rắn E. Cho E tác dụng với dung dịch NaOH dư, thấy tan một phần và còn lại chất rắn G. Hoà tan hết G trong lượng dư dung dịch H2SO4 loãng rồi cho dung dịch thu được tác dụng với dung dịch KMnO4. Giải thích thí nghiệm trên bằng các phương trình phản ứng.
2. Chia hỗn hợp gồm 2 kim loại A, B có hoá trị n, m làm 3 phần bằng nhau.
Phần 1: Hoà tan hết trong axit HCl thu được 1,792 lit H2 (đktc).
Phần 2: Cho tác dụng với dung dịch NaOH dư thu được 1,344 lit khí (đktc) và còn lại chất rắn không tan có khối lượng bằng 4/13 khối lượng mỗi phần.
Phần 3: Nung trong oxi dư thu được 2,84g hỗn hợp gồm 2 oxit là A2On và B2Om. Tính tổng khối lượng mỗi phần và xác định 2 kim loại A và B.
Câu V: (4 điểm)
Có dung dịch X chứa 2 muối của cùng một kim loại.
TN1: Lấy 100 ml dung dịch X cho tác dụng với dung dịch BaCl2 dư thu được kết tủa A chỉ chứa một muối. Nung toàn bộ kết tủa A đến khối lượng không đổi thu được 0,224 lít khí B (đktc) có tỉ khối đối với hiđro là 22; khí B có thể làm đục nước vôi trong.
TN2: Lấy 100ml dung dịch X cho tác dụng với dung dịch Ba(OH)2 (lượng vừa đủ) thu được 2,955 gam kết tủa A và dung dịch chỉ chứa NaOH.
Tìm công thức và nồng độ mol của các muối trong dung dịch X.
Đáp án đề thi học sinh giỏi môn Hóa học lớp 9
Câu I: (3 điểm)
Ý 1 (1,5 điểm)
Gọi Z, N, E và Z', N', E' là số hạt proton, notron, electron của hai nguyên tố A, B. Ta có các phương trình:
Z + N + E + Z' + N' + E' = 78. ( 0,25đ)
hay: (2Z + 2Z' ) + (N + N') = 78 (1) (0,25đ)
(2Z + 2Z' ) - (N + N') = 26 (2) (0,25đ)
(2Z - 2Z' ) = 28
hay: (Z - Z' ) = 14 (3) (0,25đ)
Lấy (1) + (2) sau đó kết hợp với (3) ta có: Z = 20 và Z' = 6 (0,25đ)
Vậy các nguyên tố: A là Ca; B là C. (0,25đ)
Ý 2: (1,5 điểm)
Trích mẫu thử và đánh số lần lượt.
Cho quì tím vào các mẫu thử nhận được:
- NaHSO4: Làm quì tím chuyển sang màu đỏ (Nhóm I)
- Na2CO3 và KOH: Làm quì tím chuyển sang màu xanh (Nhóm II)
- BaCl2 và MgCl2: Không làm quì tím chuyển màu (Nhóm III) (0,5đ)
Dùng NaHSO4 cho tác dụng với chất nhóm (II):
Có khí thoát ra là dung dịch Na2CO3. Còn lại là dung dịch KOH
Na2CO3 + 2 NaHSO4→ 2Na2SO4 + H2O + CO2 ↑
2 KOH + 2NaHSO4 →Na2SO4 + K2SO4 + 2H2O (0,5đ)
Dùng NaHSO4 cho tác dụng với chất nhóm (III):
Có kết tủa trắng là dung dịch BaCl2. Còn lại là MgCl2
BaCl2 + NaHSO4→ BaSO4 + NaCl + HCl (0,5đ)
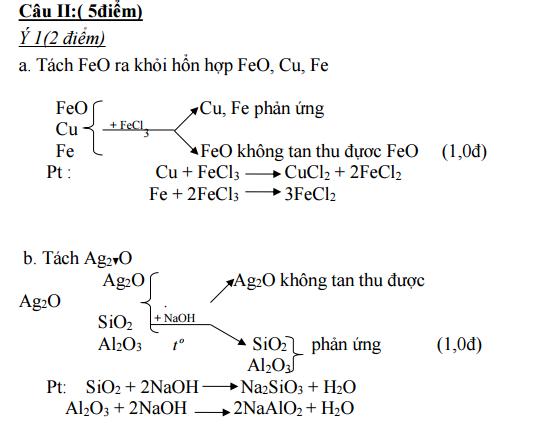
Ý 2: (3 điểm)
Phương trình phản ứng:
CaCO3 + 2 HCl→ CaCl2 + CO2 ↑+ H2O (0,25đ)
nCO2 = 26,88 : 22,4 = 1,2 mol
mNaOH = V.D =1000.1,28 = 1280 g (0,25đ)
nNaOH =1280x5/ 100x40 = 1,6 mol. (0,25đ)
Xét tỉ lệ mol CO2 và NaOH ta thấy:
nCO2: nNaOH = 0,75 (0,25đ)
1: 2 < 0,75 < 1:1
Vậy phản ứng tạo ra 2 muối: muối trung hòa và muối axit.
Phương trình phản ứng: (0,25đ)
CO2 + NaOH→ NaHCO3
1mol 1mol 1mol (0,25đ)
CO2 + 2NaOH→ Na2CO3 + H2O
1mol 2mol 1mol (0,25đ)
Gọi x là số mol CO2 phản ứng tạo muối axit.
Gọi y là số mol CO2 phản ứng tạo muối trung hòa.
Dựa vào phưong trình ta có:
Tổng số mol CO2: x + y = 1,2 (1) (0,25đ)
Tổng số mol NaOH: x + 2y = 1,6 (2) (0,25đ)
Giải hệ phương trình (1) và (2) ta được: x = 0,8 ; y = 0,4 (0,25đ)
Vậy: Khối lượng của muối NaHCO3 là:
mNaHCO3 = 0,8 x 84 = 67,2 g (0,25đ)
Khối lượng của muối Na2CO3
MNa2CO3 = 0,4 x 106 = 42,4g (0,25đ)
Câu III: (5 điểm)
Ý 1: (2 điểm)
Đặt A là kim loại hóa trị II, a là khối lượng phân tử của A.(0,25đ)
Đặt X là gốc axit hóa trị I, b là khối lượng phân tử của X (0,25đ)
Vậy công thức hóa học của muối là AX2 (0,25đ)
Phương trình phản ứng:
AX2 + 2 NaOH→ A(OH)2 + 2 NaX (0,25đ)
1mol 1mol 2mol
0,15 mol 0,15mol 0,3 mol (0,25đ)
Ta có MA(OH) = a + 34
MNaX = 23 + b
mA(OH) = 0,15 x (a + 34)
8,7 = 0,15 a + 5,1
a = 3,6: 0,15
a = 24 (0,25đ)
Vậy A là Mg (1)
mNaX = 0,3 x (23 + b)
17,55 = 6,9 + 0,3 b
b = 10,65 : 0,3
b = 35,5
Vậy X là Cl (2) (0,25đ)
(1) và (2) => Công thức hóa học của muối là MgCl2 (0,25đ)
Ý 2: (3 điểm)
Do lượng HCl dư nên Mg, Fe được tan hết (0,25đ)
Mg + 2HCl→ MgCl2 + H2 (1)
Fe + 2HCl→ FeCl2 + H2 (2)
Dung dịch thu được ở trên khi tác dụng với dung dịch NaOH dư xuất hiện kết tủa
FeCl2 + 2NaOH →2NaCl + Fe(OH)2 (3)
MgCl2 + 2NaOH→ NaCl + Mg(OH)2 (4) (0,25đ)
Khi đem nung kết tủa trong không khí đến khối lượng không đổi xảy ra các phản ứng
Mg(OH)2→ MgO + H2O (5)
4Fe(OH)2 + O2→ 2Fe2O3 + 4H2O (6) (0,25đ)
Gỉa sử trong hỗn hợp ban đầu có x mol Mg và y mol Fe, theo giả thiết ta có phương trình
24x + 56y = m (*) (0,25đ)
Mặt khác theo định luật bảo tòan suy ra số phân tử gam Mg(OH)2 là x; số phân tử gam Fe(OH)2 là y.
Khi nung khối lượng chất rắn giảm 1 lượng

Câu IV: (3 điểm)
Ý 1: (1 điểm)
Hoà tan hỗn hợp A vào lượng dư nước có các phản ứng:
BaO + H2O→ Ba(OH)2 (0,25 đ)
Al2O3 + Ba(OH)2→ Ba(AlO2)2 + H2O
Phần không tan B gồm: FeO và Al2O3 dư (do E tan một phần trong dung dịch NaOH) dung dịch D chỉ có Ba(AlO2)2.
Sục khí CO2 dư vào D: (0,25 đ)
Ba(AlO2)2 + 2CO2 + 4H2O→ 2Al(OH)3 + Ba(HCO3)2
Sục khí CO dư qua B nung nóng có phản ứng:
FeO + CO→ Fe + CO2 ↑
chất rắn E gồm: Fe và Al2O3
Cho E tác dụng với dung dịch NaOH dư:
Al2O3 + NaOH→ 2NaAlO2 + H2O (0,25 đ)
chất rắn G là Fe
Cho G tác dụng với H2SO4:
Fe + H2SO4 → FeSO4 + H2 ↑ (0,25 đ)
Và dung dịch thu được tác dụng với dung dịch KMnO4
10FeSO4 + 2KMnO4 + 8H2SO4→ 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O
Ý 2: (2điểm)
Gọi a, b là số mol của A, B trong mỗi phần.
Phần 1:
Viết PTHH:
Số mol H2 =na/2 + nb/2= 1,792 : 22,4 = 0,08 mol ----> na + mb = 0,16 (I) (0,5đ)
Phần 2:
Tác dụng với NaOH dư chỉ có 1 kim loại tan, giả sử A tan.
A + (4 – n)NaOH + (n – 2)H2O ---> Na4 – nAO2 + n/2 H2
a (mol) na/2 (mol)
Số mol H2 = na/2 = 1,344 : 22,4 ---> na = 0,12 (II)
Thay vào (I) --> mb = 0,04. (0,5đ)
Mặt khác khối lượng B trong mỗi phần:
mB = 4/13.m1/3 hh
Phần 3:
Viết PTHH:
mhh oxit = (2MA + 16n).a/2 + (2MB + 16m).b/2 = 2,84
= MA + MB + 8(na + mb) = 2,84 ---> MA + MB = 1,56 (g) (*)
mB = 4/13. 1,56 = 0,48 (g) ----> mA = 1,08 (g) (0,5đ)
---> MA = 1,08n : 0,12 = 9n --> n = 3 và MA = 27 là phù hợp.
Vậy A là Al
---> MB = 0,48m : 0,04 = 12m --> m = 2 và MB = 24 là phù hợp.
Vậy B là Mg. (0,5đ)
Câu V: (4 điểm)
Từ TN1 và TN2, ta thấy đây chỉ có thể là hai muối của kim loại Na.
Từ TN1, kết tủa A chỉ có thể là muối của Ba (vì nếu muối của Na thì sẽ tan). ( 0,5đ)
Khi nung A cho khí B có M = 22 . 2 = 44 và B làm đục nước vôi trong, vậy B là CO2.
Do đó kết tủa A là muối BaCO3 trong dung dịch X có chứa muối Na2CO3. (0,5đ)
Từ TN2, khi X tác dụng với Ba(OH)2 chỉ tạo ra BaCO3 và dung dịch NaOH, nên trong dụng X, ngoài Na2CO3 còn có chứa muối NaHCO3. (0,5đ)
Các phương trình phản ứng:
Na2CO3 + BaCl2 → BaCO3 + 2NaCl (1)
BaCO3→ BaO + CO2 (2) (0,5đ)
Na2CO3 + Ba(OH)2 → BaCO3 + 2NaOH (3)
NaHCO3 + Ba(OH)2 → BaCO3 + NaOH + H2O. (4) (0,5đ)
Theo (1) và (2): số mol CO2 = số mol BaCO3 = số mol Na2CO3 = 0,01 mol.
Theo (3) và (4): số mol BaCO3 = 0,015 mol
Số mol NaHCO3 = số mol BaCO3 tạo ra từ (4) = 0,015 – 0,01 = 0,005 mol. (0,5đ)
Kết luận:
Nồng độ mol của Na2CO3 0,1 M. (0,5đ)
Nồng độ mol của NaHCO3 0,05M. (0,5đ)








