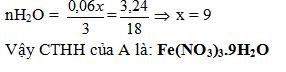Đề thi chọn học sinh giỏi môn Hóa học lớp 9 huyện Vĩnh Tường
Đề thi chọn học sinh giỏi môn Hóa học lớp 9 huyện Vĩnh Tường, Vĩnh Phúc năm 2013 - 2014 có 6 câu hỏi, làm trong thời gian 150 phút. Đề thi có đáp án đi kèm giúp các bạn học sinh có thể kiểm tra lại kết quả một cách linh hoạt, mời các bạn tham khảo.
Đề thi HSG lớp 9 môn Địa lý huyện Vĩnh Tường năm 2013 - 2014
Đề thi chọn học sinh giỏi môn Lịch sử lớp 9 huyện Vĩnh Tường, Vĩnh Phúc năm 2013 - 2014
Đề thi học sinh giỏi môn Sinh học lớp 9 huyện Vĩnh Tường năm 2013 - 2014
|
PHÒNG GD & ĐT VĨNH TƯỜNG Đề chính thức |
ĐỀ THI CHỌN HSG LỚP 9 CẤP HUYỆN NĂM HỌC 2013 - 2014 Môn: Hóa học Thời gian làm bài: 150 phút |
Câu I (2,5 đ):
1/. Viết các phương trình phản ứng, ghi rõ điều kiện (nếu có) hoàn thành dãy biến hóa sau.
CaCO3→CaO→Ca(OH)2→CaCl2→Ca(NO3)2→ NaNO3→ O2
2/. Cho hỗn hợp gồm các chất rắn là Al2O3, SiO2, Fe2O3 vào dung dịch có chứa một chất tan X (dư), sau phản ứng thu được một chất rắn Y duy nhất. Cho biết X, Y có thể là chất gì, viết các phương trình phản ứng minh họa.
Câu II (1,5 đ):
Cho các kim loại sau: Ba, Mg, Al, Ag. Chỉ dùng một hóa chất, hãy trình bày phương pháp hóa học để phân biệt các kim loại trên. Viết phương trình hóa học minh họa.
Câu III (1,5 đ):
Có 5 hợp chất vô cơ A, B, C, D, E. Khi đốt A, B, C, D, E đều cho ngọn lửa màu vàng. A tác dụng với nước thu được O2, B tác dụng với nước thu được NH3. Khi cho C tác dụng với D cho ta chất X, C tác dụng với E thu được chất Y. X, Y là những chất khí, biết tỉ khối của X so với O2 và Y so với NH3 đều bằng 2. Hãy xác định A, B, C, D, E, X, Y và viết các phương trình phản ứng xảy ra.
Câu IV (2,0 đ):
1/. Cho 500ml dung dịch A gồm 2 axit HCl 0,08M và H2SO4 0,1M tác dụng vừa đủ với 200 ml ung dịch B gồm 2 bazơ KOH 0,3M và Ba(OH)2 xM, sau phản ứng cô cạn cẩn thận thu được hỗn hợp muối khan C. Tính x và khối lượng hỗn hợp muối khan C.
2/. Hỗn hợp X gồm Al, Fe, Cu. Lấy 3,31 gam X cho vào dung dịch HCl dư, thu được 0,784 lít H2 (đktc). Mặt khác, nếu lấy 0,12 mol X tác dụng với khí clo dư, đun nóng thu được 17,27 gam hỗn hợp chất rắn Y. Tính thành phần % về khối lượng của các chất trong X (Biết các phản ứng xảy ra hoàn toàn).
Câu V (1,0 đ):
Hòa tan a gam hỗn hợp Na2CO3 và KHCO3 vào nước thu được dung dịch A. Cho từ từ 100 ml dung dịch HCl l,5M vào dung dịch A, thu được dung dịch B và 1,008 lít khí (đktc). Cho B tác dụng với Ba(OH)2 dư thu được 29,55 gam kết tủa.
1/. Viết phương trình phản ứng xảy ra.
2/. Tính a.
Câu VI (1,5 đ):
Nung 8,08 gam một muối A, thu được các sản phẩm khí và 1,6 gam một hợp chất rắn không tan trong nước. Nếu cho sản phẩm khí đi qua 200 gam dung dịch Natri hidroxit 1,2% ở điều kiện xác định thì tác dụng vừa đủ, thu được một dung dịch gồm một muối có nồng độ 2,47%. Viết công thức hóa học của muối A, biết khi nung số oxi hóa của kim loại không thay đổi.
Đáp án đề thi chọn học sinh giỏi môn Hóa học lớp 9 huyện Vĩnh Tường
Câu I (2,5đ)
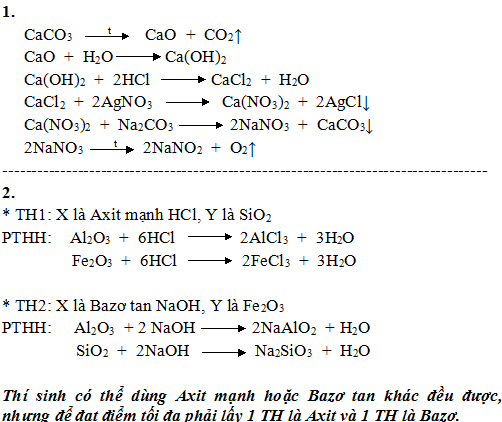
Câu II (1,5đ)
Lấy một lượng nhỏ mỗi kim loại cho vào các ống nghiệm riêng biệt, đánh số thứ tự.
Chọn thuốc thử là dung dịch H2SO4 loãng (dư) nhỏ vào các mẫu thử.
Kim loại không tan là Ag
Kim loại phản ứng tạo kết tủa trắng và có bọt khí thoát ra là Ba
Ba + H2SO4 → BaSO4↓ + H2↑
Kim loại phản ứng tạo khí và không tạo kết tủa trắng là Mg, Al
Mg + H2SO4 → MgSO4 + H2↑
2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑
Thu lấy 2 dung dịch muối tương ứng là: MgSO4 và Al2(SO4)3
Cho Ba vào dung dịch H2SO4 loãng đến khi kết tủa không tăng thêm, ta tiếp tục cho thêm 1 lượng Ba để xảy ra phản ứng:
Ba + 2H2O → Ba(OH)2 + H2
Lọc bỏ kết tủa thu được dung dịch Ba(OH)2. Cho dung dịch Ba(OH)2 dư vào các dung dịch muối MgSO4 và Al2(SO4)3
Trường hợp xuất hiện kết tủa trắng tan một phần trong dung dịch Ba(OH)2 dư là dung dịch Al2(SO4)3, suy ra kim loại tương ứng là Al.
3Ba(OH)2 + Al2(SO4)3 → 3BaSO4↓ + 2Al(OH)3↓
Ba(OH)2 + 2Al(OH)3 → Ba(AlO2)2 + 4H2O
Trường hợp xuất hiện kết tủa trắng hoàn toàn không tan trong dung dịch Ba(OH)2 dư là dung dịch MgSO4, suy ra kim loại tương ứng là Mg.
Ba(OH)2 + MgSO4 → BaSO4↓ + Mg(OH)2↓
Câu III (1,5đ)
Các hợp chất đều là hợp chất của Natri.
Khi cho C tác dụng với D cho ta chất khí X và tỉ khối của X so với O2 bằng 2: MX = 2.32 = 64.
Khi cho C tác dụng với E thu được chất khí Y và tỉ khối của Y so với NH3 bằng 2: MY = 17.2=34.
Nên C là muối axit của axit mạnh: C là NaHSO4 và X là SO2, Y là H2S.
Ta có:
| A | B | C | D | E | X | Y |
Na2O2 |
Na3N | NaHSO4 | NaHSO3 | NaHS | SO2 | H2S |
Các phương trình phản ứng
Na2O2 + 2H2O→ 2NaOH + O2↑
(A)
Na3N + 3H2O→ 3NaOH + NH3↑
(B)
NaHSO4 + NaHSO3→ Na2SO4 + SO2↑ + H2O
(C) (D) (X)
NaHSO4 + NaHS→ Na2SO4 + H2S↑
(C) (E) (Y)
Hoặc:
| A | B | C | D | E | X | Y |
| Na2O2 | Na3N | NaHSO4 | Na2SO3 | Na2S | SO2 | H2S |
2NaHSO4 + Na2SO3→ 2Na2SO4 + SO2↑ + H2O
(C) (D) (X)
2NaHSO4 + Na2S→ 2Na2SO4 + H2S↑)
(C) (E) (Y)
Thí sinh chỉ cần làm 1 trong 2 đáp án.
Câu IV (2,0đ)
1.
PTHH: HCl + KOH→ KCl + H2O
2HCl + Ba(OH)2→ BaCl2 + H2O
H2SO4 + 2KOH→ K2SO4 + 2H2O
H2SO4 + Ba(OH)2→ BaSO4 + 2H2O
Số mol của các chất là:
nHCl = 0,5.0,08 = 0,04 mol; nH2SO4 = 0,5.0,1 = 0,05 mol
nKOH = 0,2. 0,3 = 0,06 mol; nBa(OH)2 = 0,2.x mol
Áp dụng ĐLBT điện tích ta có:
nH+ = nOH- => 0,04.1 + 0,05.2 = 0,06.1 + 0,2.x.2
=> 0,08 = 0,4.x => x = 0,2 M
Áp dụng ĐLBT khối lượng ta có:
mC = (mK + mBa) + (mCl + mSO4) =
= (39.0,06 + 137.0,2.0,2) + (35,5.0,04 + 96.0,05)
= 14,04 g
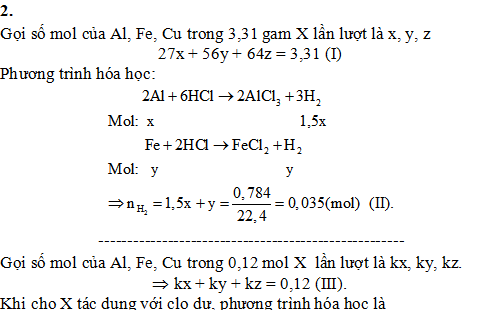
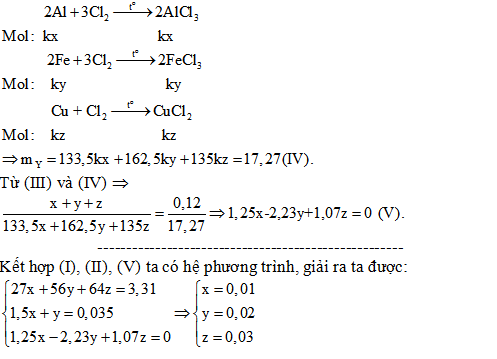

Câu V (1,0đ)
1.
Na2CO3 + HCl→ NaHCO3 + NaCl (1)
0,105 0,105 0,105
NaHCO3 + HCl→ NaCl + CO2↑ + H2O (2)
KHCO3 + HCl→ KCl + CO2↑ + H2O (3)
0,045 0,045
NaHCO3 + Ba(OH)2→ BaCO3↓ + NaOH + H2O (4)
KHCO3 + Ba(OH)2→ BaCO3↓ + KOH + H2O (5)
0,15 (dư) 0,15
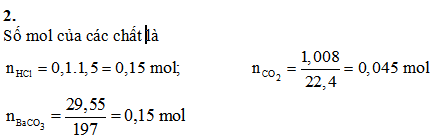
Số mol HCl phản ứng ở (2), (3) là: 0,045 mol
Số mol HCl phản ứng ở (1), là: 0,15 - 0,045 = 0,105 mol
Số mol Na2CO3 trong hỗn hợp ban đầu là: 0,105 mol
Áp dụng ĐLBT nguyên tố, tổng số mol gốc CO32- là :
0,045 + 0,15 = 0,195 mol
--------------------------------------------
Số mol KHCO3 ban đầu là:
nNa2CO3 + nKHCO3 = ngốc CO3 => 0,105 + nKHCO3 = 0,195
=> nKHCO3 = 0,09 mol
Vậy khối lượng hỗn hợp ban đầu là:![]()
Thí sinh có thể làm theo cách đặt số mol cho KHCO3 ban đầu.
Câu VI (1,5đ)
mNaOH = 0,012.200 = 2,4g; nNaOH = 2,4:40 = 0,06 mol
mkhí = 8,08 – 1,6 = 6,48g
Khối lượng dd sau khi hấp thụ khí: 200 + 6,48 = 206,48g
Khối lượng muối tạo thành là: 0, 247. 206,48 = 5,1g
Khối lượng Na trong mu ối l à: 0,06.23 = 1,38g
Khối lượng gốc axit (gốc X) là : 5,1 – 1,38 = 3,27g
---------------------------------------------
Nếu CTTQ của muối là: NaX
nX = 0,06 mol→ MX = 3,27:0,06 = 62 → X là : - NO3 (hoá trị I)
Nếu CTTQ của muối là: Na2X
nX = 0,06:2 = 0,03 mol → MX = 3,27:0,03 = 124 → không có
Nếu CTTQ của muối là: Na2X
nX = 0,06: = 0,02 mol → MX = 3,27:0,02 = 186 → không có
A là muối nitrat
---------------------------------------------
Vì sau khi nung A thu được chất rắn không tan trong nước nên A không phải là muối của kim loại kiềm và amoni.
Công thức của A: M(NO3)n.
Nhiệt phân:
→ 4M(NO3)n→ 2M2On + 4nNO2 + nO2
nO2 =nNO2: 4 = 0,06: 4 = 0,15mol; mO2 = 0,15.32 = 0,48g
→mNO2 + mO2 = 40.0,06 + 0,48 = 3,24 < 6,48. A là muối nitrat ngậm nước.
mH2O = 6,48 – 3,24 = 3,24g
CTTQ của A là:
M(NO3)n.xH2O (n=1,2,3; x = 0,1,2...)
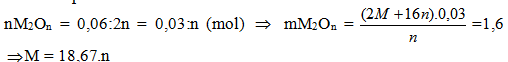
| n | 1 | 2 | 3 |
| M | 18.67 | 37,34 | 56 |
| Kết luận | Không có | Không có | Fe |