Đề thi học sinh giỏi môn Hóa học lớp 8
Đề thi học sinh giỏi môn Hóa học lớp 8 phòng GD&ĐT Nam Trực, Nam Định năm 2015 - 2016 có đáp án kèm theo được TimDapAnsưu tầm và giới thiệu là tài liệu bồi dưỡng học sinh giỏi môn Hóa học giúp các bạn học sinh tự ôn tập kiến thức, làm quen với dạng đề thi học sinh giỏi. Mời các bạn tham khảo.
Đề thi học sinh giỏi môn Toán lớp 8 phòng GD&ĐT Nam Trực, Nam Định năm 2015 - 2016
Đề thi học sinh giỏi môn Ngữ văn lớp 8 phòng GD&ĐT Nam Trực, Nam Định năm 2015 - 2016
| PHÒNG GIÁO DỤC VÀ ĐÀO TẠO NAM TRỰC |
ĐỀ THI HỌC SINH GIỎI LỚP 8 CẤP HUYỆN Năm học 2015 – 2016 Môn thi: HOÁ HỌC Thời gian làm bài: 120 phút (Đề thi gồm 01 trang) |
Bài 1: (3,5 điểm)
a, Nêu hiện tượng và giải thích thí nghiệm: Dùng muỗng sắt, đốt cháy trên ngọn lửa đèn cồn rồi đưa nhanh vào bình chứa khí oxi. Phản ứng kết thúc, cho một ít nước và mẩu quỳ tím vào lọ thủy tinh rồi lắc nhẹ.
b, Cho hình vẽ sau:
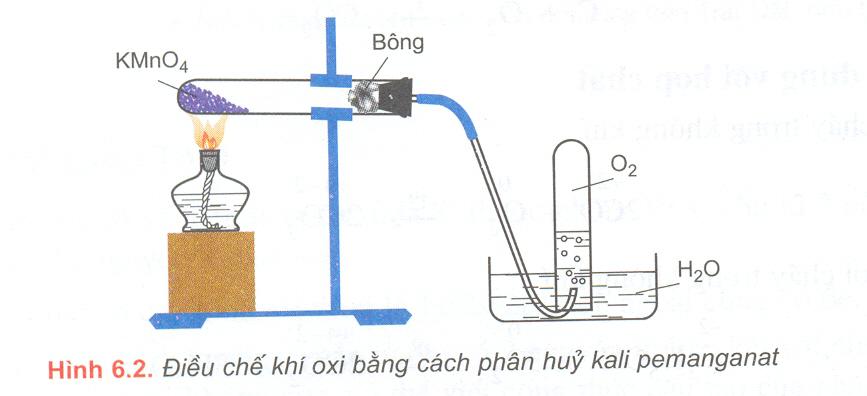
Đây là sơ đồ điều chế khí gì? Cho biết A có thể là những chất nào? Viết phương trình phản ứng xảy ra?
Tại sao người ta phải cho một ít bông ở đầu ống nghiệm? Tại sao trước khi tắt đèn cồn phải rút ống dẫn khí ra khỏi ống nghiệm thu khí?
Bài 2: (3,5 điểm)
a. Xác định các chất A, B, C, D trong dãy biến đổi hóa học sau và viết phương trình phản ứng? (Biết mỗi chữ cái A, B, C, D ứng với công thức hóa học của một chất và dung dịch của chất C làm đổi màu quỳ tím thành màu xanh)
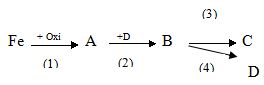
b. Cho phương trình phản ứng: 2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 3H2O
Hãy cho biết có những loại hợp chất vô cơ nào trong phản ứng trên? Đọc tên các hợp chất?
Bài 3: (2,5 điểm)
a. Xác định công thức hóa học của A biết tỉ khối của A so với H2 bằng 14?
b. Một oxit của nguyên tố A trong đó A chiếm 40% về khối lượng. Xác định công thức của oxit? Cho biết oxit trên thuộc loại oxit nào? Tại sao?
Bài 4: (2,75 điểm): Hòa tan hết 3,45 gam Natri vào m gam nước thu được dung dịch bazơ có nồng độ 10% và khí Hidro.
a. Tính m?
b. Lượng Hidro sinh ra có đủ để phản ứng với 1,6 gam Oxi hay không? Tính khối lượng sản phẩm thu được?
Bài 5: (3,5 điểm) Cho 1,34 gam hỗn hợp Al, Fe, Mg phản ứng vừa đủ với 100 gam dung dịch HCl 3,65% thu được V lít khí Hidro ở đktc và dung dịch A. Viết phương trình phản ứng xảy ra? Tính V? Cô cạn dung dịch A thu được bao nhiêu gam muối khan?
Bài 6: (2điểm) Độ tan của NaCl là ở 80oC là 38 gam, ở 25oC là 36 gam.
a, Tính nồng độ % của dung dịch NaCl bão hòa ở 80oC
b, Để thu được 207 gam dung dịch NaCl bão hòa ở 80oC cần bao nhiêu gam muối ăn và bao nhiêu gam nước?
c, Làm lạnh 207 gam dung dịch NaCl bão hòa ở 80oC xuống 25oC. Tính khối lượng muối NaCl kết tinh?
Bài 7: (2,25 điểm) Dùng H2 dư để khử hoàn toàn m gam bột sắt oxit, thu được 5,4 gam nước. Hòa tan toàn bộ lượng sắt thu được ở trên bằng dung dịch HCl dư thì thu được 25,4 gam muối. Tìm công thức oxit sắt? Tính giá trị của m?
(Cho: P= 31; Na= 23; Cl = 35,5 ; Al = 27; Fe = 56; Mg = 24; O= 16)
Đáp án đề thi học sinh giỏi môn Hóa học lớp 8
Câu 1:
a) Khi đốt trên ngọn lửa đèn cồn photpho cháy, khi đưa vào bình khí oxi photpho cháy mạnh với ngọn lửa sáng chói, tạo ra khói trắng dày đặc.
- Qùy tím đổi màu đỏ
- Phương trình phản ứng.
- Khi đốt trong oxi thì Photpho cháy mãnh liệt hơn do trong bình oxi hàm lượng oxi là 100%, trong không khí oxi chỉ chiếm khoảng 21%. Ngoài ra khi đốt trong oxi nhiệt tỏa ra chỉ làm nóng các chất trong hệ phản ứng, đốt trong không khí nhiệt bị thất thoát do ngoài làm nóng các chất trong hệ phản ứng còn làm nóng 79% các khí khác (ngoài oxi)
- Khói trắng là P2O5
- P2O5 tam trong nước tạo thành dung dịch axit H3PO4 làm đổi màu quỳ tím thành đỏ.
b) Sơ đồ điều chế khí oxi trong phòng thí nghiệm
A có thể là KMnO4 hoặc KClO3 và MnO2 (xúc tác) (Nếu không có MnO2 không cho điểm)
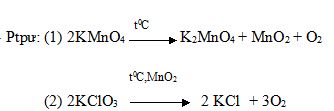
Cho một ít bông để ngăn không cho bột chất rắn đi theo luồng khí sinh ra
Trước khi tắt đèn cồn phải rút ống dẫn khí ra khỏi ống nghiệm thu khí vì khi tắt đèn cồn phản ứng xảy ra chậm dần rồi dừng hẳn nên lượng khí sinh ra ít dần rồi ngừng hẳn dẫn đến áp suất trong ống nghiệm đựng chất rắn giảm, nước bị hút ngược vào ống nghiệm có thể gây vỡ ống nghiệm.
Câu 2:
a) Xác định chất: A: Fe3O4; B: H2O; C: NaOH; D: H2
Mỗi phương trình phản ứng đúng.
b) Có 4 loại hợp chất vô cơ và đọc tên đúng cho 0,5 đ
Câu 3:
a) Tính MA = 28 g/mol.
KL: A Là nitơ (N2)
b) Gọi công thức oxit là MxOy
Tính %O = 60%
Lập biểu thức M.x /16y = 2:3
Tính M = 16/3 . (2y/x)
Kẻ bảng, kết luận nghiệm là SO3
SO3 là oxit axit vì nó là oxit của phi kim lưu huỳnh tương ứng với một axit (H2SO4)
Câu 4:
a) Tính số mol Na: 0,15 mol
Viết PTPƯ: 2Na + 2H2O → 2 NaOH + H2
Theo ptpư: Tính số mol NaOH là 0,15 mol → khối lượng NaOH là 6g → khối lượng dd NaOH là 60g
Theo ptpư: Tính số mol H2 là 0,075 mol → khối lượng H2 là 0,15g
Áp dụng ĐLBTKL: Tính m = 56,7 g
b) Tính số mol O2: 0,05 mol
Viết PTPƯ: O2 + 2H2 → 2 H2O
Theo ptpư: Biện luận được O2 dư, kết luận lượng H2 sinh ra không đủ để phản ứng với 1,6g O2
Theo ptpư: Tính số mol H2O = số mol H2 = 0,075 mol → khối lượng H2O là 1,35g
Câu 5: Viết 3 PTPƯ:
Tính thể tích của H2 là 1,12 lít
Áp dụng ĐLBTKL tính khối lượng muối là: 4,89g
Câu 6:
a) C% NaCl = 27, 536 %
b) Ở 80oC khối lượng NaCl = 57g, Khối lượng H2O = 150g
c) Ở 80oC, trong 207g dd NaCl bão hòa có:
Khối lượng NaCl = 57g, khối lượng nước = 150g.
Ở 25oC, trong 150g nước có: khối lượng NaCl = 54g
Vậy khối lượng muối NaCl kết tinh trong dung dịch = 3g
Câu 7: Số mol H2 = 0,3 mol
Gọi công thức hóa học của oxit sắt là FexOy (x, y là số nguyên dương).
PTHH:
FexOy + y H2 → xFe + yH2O (1)
Fe + 2 HCl → FeCl2 + H2 (2)
Theo PTHH (1) → Số mol H2 = Số mol H2O= 0,3 mol → Khối lượng H2 = 0,6g
Theo PTHH (2) → Số mol Fe = Số mol FeCl2 = 0,2 mol→ Khối lượng sắt = 11,2g
Lập tỉ lệ x : y = 2 : 3 → x= 2, y = 3
Công thức oxit sắt Fe2O3
Áp dụng ĐLNTKL tính khối lượng sắt oxit = m= 16 g








