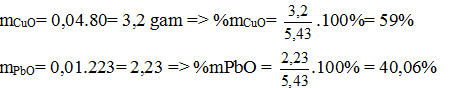Đề thi học sinh giỏi môn Hóa học lớp 8
Đề thi học sinh giỏi môn Hóa học lớp 8 tại phòng GD - ĐT Thanh Oai được Tìm Đáp Án sưu tầm và đăng tải là tài liệu ôn tập môn Hữu học hữu ích dành cho các bạn học sinh lớp 8. Hi vọng tài liệu này giúp các bạn ôn thi học sinh giỏi môn Hóa hiệu quả.
| PHÒNG GIÁO DỤC VÀ ĐÀO TẠO THANH OAI |
ĐỀ THI CHỌN HỌC SINH GIỎI MÔN: HÓA HỌC 8 Năm 2015-2016 |
Bài 1: (2,5 điểm)
Viết phương trình hóa học thực hiện chuyển đổi hóa học sau:
S→ SO2→ SO3→ H2SO4 →H2→ Cu
Gọi tên các chất có công thức hóa học như sau: Li2O, Fe(NO3)3, Pb(OH)2, Na2S, Al(OH)3, P2O5, HBr, H2SO4, Fe2(SO4)3, CaO
Bài 2: (1,5 điểm)
Cho 15,68 lít hỗn hợp gồm hai khí CO và CO2 ở đktc có khối lượng là 27,6 gam. Tính thành phần trăm theo khối lượng mỗi khí trong hỗn hợp.
Bài 3: (2 điểm)
Một muối ngậm nước có công thức là CaSO4.nH2O. Biết 19,11 gam mẫu chất có chứa 4 gam nước. Hãy xác định công thức phân tử của muối ngậm nước trên.
Bài 4 (2 điểm)
Cho 32,4 gam kim loại nhôm tác dụng với 21,504 lít khí oxi ở điều kiện tiêu chuẩn.
a/ Chất nào còn dư sau phản ứng? khối lượng chất còn dư là bao nhiêu gam?
b/ Tính khối lượng nhôm oxit tạo thành sau phản ứng.
c/ Cho toàn bộ lượng kim loại nhôm ở trên vào dung dịch axit HCl. Sau khi phản ứng xảy ra hoàn toàn thu được bao nhiêu lít khí H2 ở đktc.
Bài 5 (2 điểm)
Khử hoàn toàn 5,43 gam hỗn hợp CuO và PbO bằng khí hyđro, chất khí thu được dẫn qua bình đựng P2O5 thấy khối lượng bình tăng lên 0,9 gam.
a/ Viết phương trình hóa học.
b/ Tính thành phần phần trăm theo khối lượng của mỗi oxit trong hỗn hợp ban đầu.
Cho biết:Al = 27, O = 16, H = 1, Cu = 64, Pb = 207, Ca = 40, S = 32, C =12
Đáp án đề thi học sinh giỏi môn Hóa học lớp 8
Câu 1:
1/ Viết phương trình hóa học: (1,5 điểm) (Mỗi PTHH được 0,3 điểm)
S + O2 → SO2
2SO2 + O2 → 2SO3
SO3 + H2O → H2SO4
H2SO4 + Zn→ ZnSO4 + H2
H2 + CuO → Cu + H2O
2/ Gọi tên các chất: (1 điểm) (Mỗi chất gọi tên đúng được 0,1 điểm)
| Li20 | Liti oxit | P2O5 | Đi photpho penta oxit |
| Fe(NO3)3 | Sắt (III) nitrat | HBr | Axit brom hyđric |
| Pb(OH)2 | Chì (II) hyđroxit | H2SO4 | Axit sunfuric |
| Na2S | Natri sunfua | Fe2(SO4)3 | Sắt (III) sunfat |
| Al(OH)3 | Nhôm hyđroxit | CaO | Canxi oxit |
Câu 2:
Số mol hỗn hợp: nCO, CO2 = 15,68 /22,4 = 0,7 (0,25 điểm)
Gọi số mol CO và CO2 là x và y (x, y > 0) (0,5 điểm)
Ta có PTĐS: x + y = 0,7 => x = 0,7 – y (1)
28x + 44y = 27,6 (2)
Thay x = 0,7 – y vào (2) giải ra ta được: x = 0,2; y = 0,5 (0,25 điểm)
mCO = 0,2.28 = 5,6 gam; mCO2 = 0,5.44 = 22 gam (0,25 điểm)
%mCO2 = 79,7% ; % mCO = 20,3 % (0,25 điểm)
Câu 3:
| Theo đầu bài ta có tỷ lệ: Giải ra ta được n = 2 Vậy công thức hóa học của muối là CaSO4.2H2O Câu 4. PTHH: 4Al + 3O2 → 2Al2O3 Số mol Al: Ta có tỷ lệ: nAl(ĐB)/nAl(PTHH) = 1,2/4 = 0,3 nO2 (ĐB)/nO2 (PTHH) = 0,96/3 = 0,32 => nO2 > nAl Vậy oxi còn dư sau phản ứng: nO2 pư = 3/4nAl = 0,9 mol => mO2 dư = 0,06.32 = 1,92 gam Theo phương trình hóa học ta có: nAl2O3 = 1/2nAl => nAl2O3 = 0,6 mAl2O3 = 0,6.102 = 61,2 gam Phương trình hóa học: 2Al + 6HCl → 2AlCl3 + 3H2 Theo phương trình hóa học ta có: nH2 = 3/2nAl => nH2 = 1,8 mol VH2 = 1,8.22,4 = 40,32 lít |
|
Câu 5:
Phương trình hóa học
CuO + H2 → Cu + H2O (1) (1 điểm)
PbO + H2 → Pb + H2O (2) (0,5 điểm)
Sau phản ứng chất khí dẫn qua bình đựng P2O5 thấy khối lượng bình giảm 0,9 gam =>mH2O = 0,9 gam => nH20 = 0,9 /18 = 0,05 mol (0,25 điểm)
Gọi số mol CuO và PbO lần lượt là x mol và y mol (x,y > 0) (0,3 điểm)
Ta có PTĐS: 80x + 223y = 5,43 =>
Theo PTHH (1) ta có: nH20 = nCuO= x mol
Theo PTHH (2) ta có: nH2O = nPbO = y mol
x + y = 0,05 => y = 0,05 – x (b) (0,25 điểm)
Thay (b) vào (a) giai ra ta có x = 0,04; y = 0,01 mol
Vậy % theo khối lượng của CuO và PbO là 59%; 40,06% (0,2 điểm)
.................................................
Mời các bạn tham khảo một số tài liệu liên quan:
- Hóa học 8 Bài 18: Mol
- Giải bài tập SBT Hóa học lớp 8 bài 17: Luyện tập chương 2
- Trắc nghiệm Hóa học 8 bài 17
Để có kết quả cao hơn trong học tập, TimDapAnxin giới thiệu tới các bạn học sinh tài liệu Chuyên đề Toán 8, Chuyên đề Vật Lý 8, Chuyên đề Hóa 8, Tài liệu học tập lớp 8 mà TimDapAntổng hợp và đăng tải.