Đề thi học kì 2 môn Hóa học lớp 11
Đề thi học kì 2 môn Hóa học lớp 11 trường THPT Đa Phúc, Hà Nội năm học 2015 - 2016 là đề kiểm tra học kì II lớp 11 được Tìm Đáp Án sưu tầm và giới thiệu tới các bạn. Đề thi có đáp án đi kèm, hi vọng sẽ giúp các bạn ôn tập và củng cố kiến thức, ôn thi học kì II lớp 11 hiệu quả. Mời các bạn tham khảo.
Đề thi học kì 2 môn Hóa học lớp 11 trường THPT Đa Phúc, Hà Nội năm 2015
Đề thi học kì 2 môn Hóa học lớp 11 Nâng cao trường THPT Chuyên Huỳnh Mẫn Đạt, Kiên Giang năm 2015
|
Trường THPT Đa Phúc Năm học: 2015-2016 ---------š&›--------- Mã đề thi 111 |
KIỂM TRA HỌC KÌ 2 Môn: Hóa học - Lớp 11 Thời gian: 45 phút (Lưu ý: HS phải ghi mã đề thi vào bài làm) |
I/ Trắc nghiệm. (3 điểm)
Câu 1. Chất nào dưới đây có nhiệt độ sôi cao nhất?
A. Etanol. B. Propan-1-ol. C. Etylclorua. D. Đietylete.
Câu 2. Để điều chế khí axetilen trong phòng thí nghiệm, người ta sử dụng phương pháp:
A. Thủy phân canxi cacbua. B. Thủy phân dẫn xuất halogen.
C. Cộng hợp hiđro vào anken. D. Muối natriaxetat tác dụng với vôi tôi xút.
Câu 3. Số đồng phân ankan có công thức phân tử C6H14 là:
A. 3 B. 4 C. 5 D. 6
Câu 4. Cho các chất sau: etilen, propan, toluen, axetilen, buta-1,3-đien, hex-1-in. Số chất làm mất màu dung dịch nước brom là:
A. 4 B. 5 C. 2 D. 3
Câu 5. Hỗn hợp X gồm ancol etylic và phenol. Nếu cho X tác dụng với dung dịch NaOH thì cần vừa đủ với 100 ml dung dịch NaOH 1M. Nếu cho X tác dụng với Na thì thu được 3,36 lít khí H2 ở đktc. Khối lượng của hỗn hợp X là:
A.37,2g B. 13,9g C. 14g D. 18,6g
Câu 6. Hỗn hợp A gồm propin và hiđro có tỉ khối hơi so với H2 là 10,5. Nung nóng hỗn hợp A với xúc tác Ni một thời gian thu được hỗn hợp khí B có tỉ khối hơi so với H2 là 15. Hiệu suất của phản ứng hiđro hóa là:
A. 50% B. 55% C. 60% D. 65%
II/ Tự luận. (7 điểm)
Câu 1: (2,5 điểm)
Viết các phương trình hoá học dưới dạng CTCT thu gọn của các phản ứng sau:
(ghi rõ điều kiện phản ứng và chỉ viết sản phẩm chính)
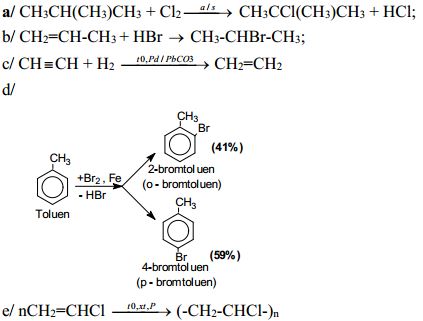
a) Phản ứng thế clo vào phân tử isobutan (tỉ lệ mol 1 : 1).
b) Phản ứng cộng phân tử HBr vào phân tử propen.
c) Đun nóng axetilen với hiđro (xúc tác Pd/PbCO3)
d) Đun nóng Br2 với toluen có xt bột Fe theo tỉ lệ mol 1:1.
e) Trùng hợp vinylclorua.
Câu 2: (1,5 điểm)
Bằng phương pháp hóa học, phận biệt các chất lỏng sau: pentan, etanol, phenol, stiren. Viết các phương trình hóa học xảy ra.
Câu 3: (3 điểm)
Đốt cháy hoàn toàn hỗn hợp X gồm 2 ancol no, đơn chức, mạch hở kế tiếp nhau trong dãy đồng đẳng thì thu được 6,72 lít khí CO2 ở đktc và 7,56 gam H2O.
a) Xác định CTPT, viết CTCT và gọi tên 2 ancol trên biết khi oxi hóa hỗn hợp X bằng CuO nung nóng thu được hỗn hợp anđêhit.
b) Tính phần trăm theo khối lượng của mỗi ancol trong hỗn hợp.
c) Lấy 0,2 mol X tác dụng với 250 ml dung dịch CH3COOH 1M (xúc tác H2SO4 đặc nóng) thu được m gam este với hiệu suất các phản ứng este hóa là 60%. Tính m.
(Cho C = 12, H = 1, O = 16, Na = 23, K = 39)
Đáp án đề thi học kì 2 môn Hóa học lớp 11
Đáp án mã đề 111
I. Trắc nghiệm (3,0 đ): Mỗi câu đúng 0,5đ x 6 = 3đ
Câu |
1 |
2 |
3 |
4 |
5 |
6 |
Đáp án |
B |
A |
C |
A |
D |
C |
II. Tự luận (7,0 đ)
Câu 1. (2,5đ). Viết đúng sản phẩm và cân bằng được 0,5đ x 4pt = 2đ
(viết đúng sản phẩm nhưng không cân bằng, thiếu điều kiện được 0,25đ)
Câu 2. (1,5 đ)
Lấy mẫu thử: Lấy mỗi chất một ít ra các ống nghiệm tương ứng có đánh số từ 1 đến 4: 0,25đ
Phân biệt được các chất: 1đ; pthh viết đúng: 0,75đ
Pentan |
Etanol |
Phenol |
Stiren |
|
Dd Br2 |
- |
- |
↓trắng |
Mất màu dd Br2 |
Na |
- còn lại |
bay hơi |
X |
X |
Câu 3. (3,0 đ)
a/ nCO2 = 0,3mol; nH2O = 0,42 mol => n ancol = nH2O – nCO2 = 0,12
Đặt CTPTC là CnH2n+1OH
=> Số Ctb = nCO2/n ancol = 0,3/0,12 = 2,5. Vì 2 chất là đồng đẳng liên tiếp
=> CTPT là: C2H5OH và C3H7OH
CTCT: CH3-CH2- OH: etanol
CH3-CH2-CH2-OH: propan-1-ol
b/ AD sơ đồ đường chéo => số mol 2 chất bằng nhau = 0,06
(hoặc viết 2 pt đốt cháy, giải hệ pt => số mol = 0,06 mol)
%m C2H5OH = 0,06.46.100/6,36 = 43,4%; %m C3H7OH = 56,6%
c/ CH3COOH + CnH2n+1OH -> CH3COOCnH2n+1 + H2O (có n = 2,5)
tổng số mol 2 ancol = 0,2 mol; số mol CH3COOH = 0,25 => tính theo ancol
Do H = 60% => nancol pư = 0,2.60% = 0,12 mol
M este = 95 => m este = 0,12.95 = 11,4g











