Đề thi cuối học kì 1 môn Hóa học 10 trường THPT Bất Bạt năm học 2020-2021 Có đáp án
Đề thi cuối học kì 1 môn Hóa học 10 trường THPT Bất Bạt năm học 2020-2021 Có đáp án là bộ tài liệu hay và chất lượng được Tìm Đáp Án sưu tầm và đăng tải từ các trường THCS trên cả nước, nhằm cung cấp cho các bạn nguồn tư liệu hữu ích để ôn thi học kì 1 sắp tới. Bộ tài liệu này bám sát nội dụng nằm trong chương trình học môn Hóa học 10 học kì 1 giúp các bạn học sinh ôn luyện củng cố, bổ sung thêm kiến thức, các dạng bài tập qua đó trong kì thi học kì tới đạt kết quả cao. Thầy cô có thể tham khảo bộ tài liệu này để ra câu hỏi trong quá trình ra đề thi. Mời thầy cô cùng các bạn tham khảo chi tiết đề thi.

Câu 1: Trong phản ứng: Zn + CuCl2 → ZnCl2 + Cu thì 1 mol Cu2+
A. nhường 1 mol electron B. nhường 2 mol electron
C. nhận 2 mol electron D. nhận 1 mol electron
Câu 2: Hòa tan hoàn toàn 9,6 gam Cu bằng dung dịch H2SO4 đặc nóng dư, thu được x mol SO2 (là sản phẩm khử duy nhất của N+5). Giá trị của x là
A. 0,25. B. 0,05. C. 0,15. D. 0,10.
Câu 3: Công thức electron của HCl là

Câu 4: Tổng số các loại hạt cơ bản trong nguyên tử X bằng 58 hạt, trong đó số hạt mang điện tích âm ít hơn số hạt không mang điện là 1 hạt. Tổng số hạt mang điện của X là
A. 20. B. 38. C. 19. D. 39.
Câu 5: Phân tử NH3 có kiểu liên kết
A. cho – nhận. B. cộng hóa trị phân cực.
C. cộng hóa trị không phân cực. D. ion .
Câu 6: Cho những nguyên tử của các nguyên tố sau:
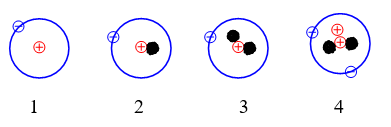
Đồng vị có tên triti là?
A. 1 và 2 B. 2 và 3 C. 3 D. 2
Câu 7: Cho 6,4 gam hỗn hợp hai kiêm loại A và B (nhóm IIA, thuộc hai chu kì liên tiếp) tác dụng với dung dịch HCl dư, thu được 4,48 lít khí H2 (đktc). Hai kim loạ A, B là
A. Be, Mg B. Ca, Sr C. Mg, Ca D. Sr, Ra
Câu 8: Số oxi hóa của nitơ trong , HNO3 , NH3 lần lượt là
A. −3 ; + 4 ; +5. B. +3 ; +5 ; +3. C. 3 ; +5 ; −3. D. −3 ; +5 ; −3.
Câu 9: M là nguyên tố thuộc nhóm IIA,X là nguyên tố thuộc nhóm VIIA. Trong oxit cao nhất M chiếm 71,43% khối lượng, X chiếm 38,8% khối lượng. Liên kết giữa M và X thuộc loại liên kết nào?
A. Cả liên kết ion và liên kết CHT. B. Liên kết CHT.
C. Liên kết ion. D. Liên kết cho–nhận.
Câu 10: Đại lượng nào dưới đây của các nguyên tố biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân?
A. Nguyên tử khối. B. Số hiệu nguyên tử.
C. Số electron trong nguyên tử. D. Số eletron lớp ngoài cùng.
Câu 11: Cho độ âm điện các nguyên tố lần lượt là: N(3,04), Cl(3,16) , O (3,44), F(3,98). Thứ tự sắp xếp theo chiều tính phi kim giảm dần là
A. F,O,Cl,N B. N,Cl,O,F C. F,Cl,O, N D. F,N,O,Cl
Câu 12: Liên kết trong phân tử NaCl là liên kết
A. cộng hóa trị phân cực. B. ion.
C. cho – nhận. D. cộng hóa trị không phân cực.
Câu 13: Nguyên tố có số hiệu nguyên tử bằng 11 thuộc vị trí nào trong bảng tuần hoàn ?
A. Chu kì 4,nhóm IIA. B. Chu kì 3,nhóm IA.
C. Chu kì 4,nhóm IA D. Chu kì 3,nhóm IIA.
Câu 14: Phản ứng phân hủy thuộc phản ứng
A. thuận nghịch. B. không oxi hóa- khử.
C. oxi hóa- khử hoặc không. D. oxi hóa- khử.
Câu 15: Một nguyên tử X có số hiệu nguyên tử Z = 19. Số lớp electron trong nguyên tử X là
A. 4. B. 3. C. 6. D. 5.
Câu 16: Nitơ trong thiên nhiên là hỗn hợp gồm hai đồng vị là 14 N (99,63%) và 15 N (0,37%). Nguyên tử khối trung bình của nitơ là
A. 14,0. B. 14,7. C. 14,4. D. 13,7
Câu 17: Cho các phát biểu sau:
a) Điện hóa trị của một nguyên tố là hóa trị của nguyên tử nguyên tố đó trong hợp chất ion.
b) Cộng hóa trị của một nguyên tố là hóa trị của nguyên tử nguyên tố đó trong hợp chất cộng hóa trị.
c) Điện hóa trị của một nguyên tố bằng điện tích ion của nguyên tử nguyên tố đó trong phân tử.
d) Cộng hóa trị của một nguyên tố bằng số liên kết của nguyên tử nguyên tố đó với các nguyên tử khác trong phân tử.
e) Số oxi hóa của đơn chất luôn bằng không trừ chất rắn.
f) Số oxi hóa của oxi trong hợp chất luôn là -2.
Số pháp biểu đúng là
A. 6 B. 5 C. 4 D. 3
Câu 18: Cho các phản ứng sau
(1) 2SO2 + O2 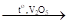 2SO3.
2SO3.
(2) SO2 + 2H2O + Br2 → H2SO4 + 2HBr.
(3) SO2 + 2H2S → 2H2O + 3S.
(4) 5SO2 + 2KMnO4 + 2H2O → K2SO4 + 2MnSO4 + 2H2SO4.
(5) SO2 + 2KOH → K2SO3 + H2O
Các phản ứng trong đó SO2 đóng vai trò chất khử là
A. 1, 3, 5. B. 1, 2, 4. C. 3,4,5. D. 2, 3, 4.
Câu 19: Số hiệu nguyên tử của nito là 7. Trong nguyên tử nito, số electron ở phân mức năng lượng cao nhất là
A. 2. B. 7. C. 5. D. 3.
Câu 20: Nung 7,84 gam Fe trong không khí, sau một thời gian, thu được 10,24 gam hỗn hợp rắn X. Cho X phản ứng hết với dung dịch HNO3 (loãng, dư), thu được V ml khí NO (sản phẩm khử duy nhất của N+5, ở đktc). Giá trị của V là
A. 2240. B. 2688. C. 3136. D. 896.
Câu 21: Nguyên tố ở chu kỳ 3, nhóm IIIA có cấu hình electron nguyên tử là
A. 1s22s22p63s23p1. B. 1s22s22p63s23p3. C. 1s22s22p63s23p5. D. 1s22s22p63s23p2.
Câu 22: Một nguyên tố R có cấu hình electron: 1s22s22p3, công thức hợp chất với hidro và công thức oxit cao nhất là
A. RH3, R2O5. B. RH3, R2O3 C. RH2, RO D. RH4, RO2
Câu 23: Phát biểu nào sau đây không đúng? Trong một chu kỳ, đi từ trái sang phải
A. các nguyên tố được sắp xếp theo chiều điện tích hạt nhân tăng dần.
B. các nguyên tố được sắp xếp theo chiều số hiệu nguyên tử tăng dần.
C. các nguyên tố đều có cùng số lớp electron.
D. các nguyên tố được sắp xếp theo chiều khối lượng nguyên tử tăng dần.
Câu 24: Các phân tử nào sau đây đều có liên kết cộng hoá trị không phân cực:
A. N2, Cl2, I2, H2, F2. B. NO2, Cl2, HI, H2, F2.
C. N2, Cl2, HCl, H2, F2. D. N2, Cl2, CO2, H2, HF.
Câu 25: Trong nguyên tử , số electron tối đa ở lớp thứ 4 là
A. 32. B. 18. C. 16. D. 50.
Câu 26: Cho 1,95 gam hai kim loại thuộc nhóm A vào cốc chứa lượng dư H2O thu được dung dịch X và 0,56 lít khí (đo ở ĐKTC). Kim loại là
A. Al B. K C. Fe D. Ca
Câu 27: Cho phương trình phản ứng: HCl + KMnO4 → KCl + MnCl2 + Cl2 + H2O
Sau khi cân bằng tổng hệ số của các chất tham gia phản ứng là là
A. 16 B. 35 C. 18 D. 17
Câu 28: Khối lượng nguyên tử trung bình của clo (Cl) là 35,5. Trong tự nhiên clo có hai đồng vị trong đó một đồng vị là 35Cl chiếm 75%. Tìm số khối của đồng vị còn lại.
A. 38. B. 37. C. 71. D. 36.
Câu 29: Nhóm I A gồm các nguyên tố Li-Na-K-Rb-Cs có tên gọi khác là
A. khí hiếm. B. halogen.
C. kim loại kiềm thổ. D. kim loại kiềm.
Câu 30: Có 3 nguyên tử: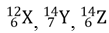 . Những nguyên tử nào là đồng vị của một nguyên tố?
. Những nguyên tử nào là đồng vị của một nguyên tố?
A. X, Z. B. X, Y. C. X, Y, Z. D. Y, Z.
Câu 31: Nguyên tử nguyên tố X có số hiệu nguyên tử là 20, chu kì 4, nhóm IIA. Phát biểu nào sau đây sai?
A. Hạt nhân của X có 20 proton.
B. Vỏ nguyên tử X có 4 lớp electron và lớp ngoài cùng có 2 electron.
C. Số e ở vỏ nguyên tử của nguyên tố X là 20.
D. Nguyên tố hoá học này là một phi kim.
Câu 32: Hai nguyên tố X, Y đứng kế nhau trong cùng một chu kì của bảng tuần hoàn có tổng số đơn vị điện tích hạt nhân là 25. Hai nguyên tố A, B là
A. P, S B. Mg, Al C. N, O D. Na, Mg
Câu 33: Có các phát biểu sau
(1) Trong một nguyên tử luôn luôn có số proton bằng số electron bằng số đơn vị điện tích hạt nhân.
(2) Tổng số proton và số electron trong một hạt nhân được gọi là số khối.
(3) Số khối A là khối lượng tuyệt đối của nguyên tử.
(4) Số proton bằng số đơn vị điện tích hạt nhân.
(5) Đồng vị là các nguyên tố có cùng số proton nhưng khác nhau về số nơtron.
Số phát biểu không đúng là
A. 4 B. 3 C. 1 D. 2
Câu 34: Điều khẳng định nào sau đây không đúng ? Trong một nhóm A của bảng tuần hoàn, theo chiều tăng của điện tích hạt nhân nguyên tử, thì
A. Tính phi kim của các nguyên tố tố giảm dần.
B. Tính kim loại của các nguyên tố tăng dần
C. Tính bazơ của các hiđroxit tương ứng tăng dần
D. Độ âm điện của các nguyên tố tăng dần
Câu 35: Điện hóa trị của natri trong NaCl là
A. +1 B. 1- C. 1+ D. 1
Câu 36: Một nguyên tử X có tổng số e ở các phân lớp p là 11. Hãy cho biết X thuộc về nguyên tố hoá học nào sau đây?
A. D. nguyên tố f. B. nguyên tố s. C. nguyên tố p. D. nguyên tố
Câu 37: Các hạt cấu tạo nên nguyên tử của hầu hết các nguyên tố là
A. electron, nơtron, proton. B. nơtron, electron.
C. electron, proton. D. proton, nơtron.
Câu 38: Chất khử là chất
A. nhường electron và có số oxi hoá giảm sau phản ứng.
B. nhận electron và có số oxi hoá tăng sau phản ứng.
C. nhường electron và có số oxi hoá tăng sau phản ứng.
D. nhận electron và có số oxi hoá giảm sau phản ứng.
Câu 39: Ion dương được hình thành khi :
A. Nguyên tử nhường electron. B. Nguyên tử nhận thêm electron.
C. Nguyên tử nhận thêm proton. D. Nguyên tử nhường proton.
Câu 40: Liên kết cộng hoá trị là liên kết
A. giữa các nguyên tử phi kim với nhau.
B. được hình thành do sự dùng chung electron giữa hai nguyên tử khác nhau.
C. trong đó cặp electron dùng chung bị lệch về phía một nguyên tử.
D. được tạo nên giữa hai nguyên tử bằng một hay nhiều cặp electron dùng chung.
----------------------------------------------
----------- HẾT ----------
Họ và tên thí sinh: ………………………………………………………..Lớp :………………..
Ngoài Đề thi cuối học kì 1 môn Hóa học 10 trường THPT Bất Bạt năm học 2020-2021 Có đáp án trên, các bạn có thể tham khảo thêm nhiều Bộ đề thi mới nhất như môn Toán 10, Ngữ văn 10, Tiếng Anh 10, Vật lý 10, Hóa học 10, Sinh học 10…., Sách giáo khoa lớp 10, Sách điện tử lớp 10, Tài liệu hay, chất lượng và một số kinh nghiệm kiến thức đời sống thường ngày khác mà Tìm Đáp Án đã sưu tầm và đăng tải. Chúc các bạn ôn luyện đạt được kết quả tốt!











