Giải đề thi học kì 2 hoá lớp 8 năm 2019 - 2020 THCS Hoàng Hoa Thám
Giải chi tiết đề thi học kì 2 môn hoá lớp 8 năm 2019 - 2020 Trường THCS Hoàng Hoa Thám với cách giải nhanh và chú ý quan trọng
Đề bài
Câu 1: Hoàn thành các phương trình phản ứng sau:
a) S + …. \(\xrightarrow{{{t}^{o}}}\) SO2
b) P2O5 + H2O → ……
c) Fe2O3 + H2 \(\xrightarrow{{{t}^{o}}}\) …….. + H2O
d) Zn + HCl →…….. + H2
Câu 2: Đây là hình ảnh mô phỏng thí nghiệm điều chế khí O2 trong phòng thí nghiệm. Em hãy cho biết
|
Công thức hóa học của chất rắn A: ……… PTHH điều chế khi oxi từ chất A …………………….………………… Khí oxi được thu bằng cách …………………….………………… Vì sao khí oxi có thể thu được bằng cách trên …………………….………………… |
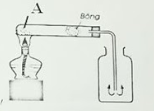 |
Câu 3:
a, Phân loại và gọi tên các oxit sau:
|
CTHH |
Tên gọi |
Phân loại |
|
HgO |
|
|
|
SO3 |
|
|
|
K2O |
|
|
|
N2O5 |
|
|
b, Bằng phương pháp hóa học, hãy nhận biết các dung dịch sau: NaOH, HCl, NaCl
Câu 4:
Tính nồng độ phần trăm (C%) của dung dịch thu được khi hòa tan hoàn toàn 20g KCl vào 480 gam nước.
Câu 5:
Nung nóng hoàn toàn 49 gam kali clorat KClO3
a) Tính thể tích khí oxi thu được
b) dùng toàn bộ khí oxi thu được trên để đốt cháy 24 gam lưu huỳnh. Hỏi lưu huỳnh có cháy hết không? Giải thích
K = 39; Cl = 35,5; O = 16; S = 32
Lời giải chi tiết
Câu 1:
Phương pháp giải:
Xem lại phần tính chất hóa học của O2, H2, H2O để xác định sản phẩm.
Sau phản ứng cần cân bằng phương trình phản ứng
Hướng dẫn giải
a) S + O2 \(\xrightarrow{{{t}^{o}}}\)SO2
b) P2O5 + 3H2O → 2H3PO4
c) Fe2O3 + 3H2 \(\xrightarrow{{{t}^{o}}}\)2Fe + 3H2O
d) Zn + 2HCl → ZnCl2 + H2
Câu 2
Phương pháp giải:
Xem lại phần điều chế oxi trong phòng thí nghiệm
Hướng dẫn giải
Công thức hóa học của chất rắn A: KMnO4
PTHH điều chế khi oxi từ chất A: 2KMnO4 \(\xrightarrow{{{t}^{o}}}\)K2MnO4 + MnO2 + O2
Khí oxi được thu bằng cách: Đẩy không khí, miệng bình hướng lên trên
Vì sao khí oxi có thể thu được bằng cách trên: Oxi nặng hơn không khí
Câu 3
a, Phương pháp giải:
Oxit bazo thường là oxit của kim loại và có bazo tương ứng
Oxxit axit thường là oxit của phi kim và có axit tương ứng
Hướng dẫn giải:
|
CTHH |
Tên gọi |
Phân loại |
|
HgO |
Thủy ngân oxit |
Oxit bazo |
|
SO3 |
Lưu huỳnh trioxit |
Oxit axit |
|
K2O |
Kali oxit |
Oxit bazo |
|
N2O5 |
Dinito pentaoxit |
Oxit axit |
b, Phương pháp giải:
Phân loại các chất trên và dựa vào đặc điểm tính chất của chúng để nhận biết
Hướng dẫn giải
Xét 3 dung dịch trên NaOH là dung dịch bazo, H2SO4 là dung dịch axit, NaCl là dung dịch muối
Lấy lần lượt 3 dung dịch trên vào 3 ống nghiệm riêng biệt.
Lần lượt thả quì tím vào cả 3 ống nghiệm
Ống nghiệm làm quì tím chuyển sang màu xanh => dung dịch đó là NaOH
Ống nghiệm làm quỳ tím chuyển sang màu hồng => dung dịch đó là H2SO4
Ống nghiệm làm quỳ tím không chuyển màu là NaCl
Câu 4
Hướng dẫn giải
Xác định mct, mdd => C%
Phương pháp giải
Khi hòa tan 20 gam KCl vào 480 gam nước
=> Khối lượng chất tan có trong dung dịch là: 20 gam
Khối lượng dung dịch = mct + m H2O = 20 + 480 = 500 (g)
=> C% KCl = 20 : 500 * 100% = 4%
Câu 5
Hướng dẫn giải
a, Viết phương trình phản ứng
Tính n KClO3
Từ tỉ lệ phương trình => nO2 => V O2
b, Viết phương trình
Dựa vào tỉ lệ phương trình xác định chất dư, hết
=> Kết luận
Hướng dẫn giải
a, nKClO3 = m/M = 49 : (39 + 35,5 + 16 * 3) = 0,4 (mol)
Ta có phương trình hóa học:
2KClO3 \(\xrightarrow{{{t}^{o}}}\)2KCl + 3O2 (1)
PT 2 3
mol 0,4 x
Từ (1) => 2x = 0,4 * 3 => x = 0,6 (mol)
nO2 = 0,6 mol
=> V O2 = 0,6 * 22,4 = 13,44 lit
b, nS = 24 : 32 = 0,75 (mol)
Ta có phương trình
S + O2 \(\xrightarrow{{{t}^{o}}}\)SO2 (2)
PT 1 1
mol 0,75 0,6
Từ (2) ta thấy 0,75 : 1 > 0,6 :1
=> S sau phản ứng còn dư, chưa cháy hết.
Nguồn: Sưu tầm
Search google: "từ khóa + timdapan.com" Ví dụ: "Giải đề thi học kì 2 hoá lớp 8 năm 2019 - 2020 THCS Hoàng Hoa Thám timdapan.com"







