Bài 34: Bài thực hành 4 Điều chế và tính chất của etilen và axetilen
1. Kiến thức cần nắm
1.1. Thí nghiệm 1: Điều chế và thử tính chất của etilen
Hình 1: Thí nghiệm điều chế etilen
Etilen được điều chế từ ancol etylic theo phương trình:
C2H5OH 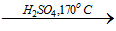
CH2=CH2 + Br2 → BrCH2 - CH2Br
1,2-đibrometan
1.2. Thí nghiệm 2: Điều chế và thử tính chất của axetilen
Hình 2: Điều chế axetilen
CaC2 + H2O → Ca(OH)2 + C2H2 ↑
C2H2 + 2AgNO3 + 2NH3 → AgC≡CAg + 2NH4NO3
2. Kĩ năng thí nghiệm
Không dùng tay cầm trực tiếp hoá chất.
Không đổ hoá chất này vào hoá chất khác ngoài chỉ dẫn.
Không đổ lại hoá chất thừa lại lọ đựng ban đầu.
Không dùng hoá chất nếu không biết hoá chất gì.
Không nếm hoặc ngửi trực tiếp hoá chất.
Khi mở lọ hoá chất và lấy hoá chất không để dây ra bàn, dùng xong đậy nắp lại ngay.
Trong 2 thí nghiệm trên khi dừng thí nghiệm phải tháo các ống nghiệm cẩn thận, đúng thứ tự các thao tác, tháo ống dẫn dd Ca(OH)2, dd Br2 trước sau đó mới tắt đèn cồn.
3. Thí nghiệm 1: Điều chế và thử tính chất của etilen
Cách tiến hành:
Cho vào ống nghiệm 1 ít cát sạch, cho tiếp vào ống nghiệm khoảng 2 ml C2H5OH khan, và chừng 4 ml H2SO4 đặc, lắc đều.
Đậy ống nghiệm bằng nút có ống dẫn khí bằng thủy tinh đầu vuốt nhọn. Kẹp ống nghiệm trên giá.
Dùng đèn cồn đun nóng đều ống nghiệm, sau đó tập trung đun phần chứa hóa chất đến khi hỗn hợp trong ống chuyển thành màu đen, có khí được tạo thành.
Đốt khí sinh ra ở đầu vuốt nhọn của ống dẫn khí, quan sát màu ngọn lửa.
Bông tẩm NaOH đặc có tác dụng giữu lại khí SO2, CO2 là những sản phẩm phụ được tạo thnàh do phản ứng của dd H2SO4 đặc với C2H5OH.
Dẫn khí C2H4 lần lượt vào ống nghiệm chứa dd Br2 và dd KMnO4
Video 1: Điều chế khí etylen
Video 2: Etilen tác dụng với dd KMnO4
Hiện tượng:
- Khí cháy sáng xanh ở đầu ống vuốt nhọn
- Brom bị mất màu nâu
- KMnO4 bị mất màu tím, xuất hiện kết tủa đen
Giải thích:
- Khí cháy sáng xanh ở đầu ống vuốt nhọn
- Brom bị mất màu nâu (do C2H4 tạo ra phản ứng với Br2)
- KMnO4 bị mất màu tím (do C2H4 tạo ra phản ứng với KMnO4, kết tủa đen sinh ra là MnO2)
- Etilen được điều chế từ ancol etylic theo phương trình:
C2H5OH 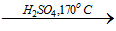
CH2=CH2 + Br2 → BrCH2 - CH2Br
1,2-đibrometan
4. Thí nghiệm 2: Điều chế và thử tính chất của axetilen
- Cách tiến hành:
Cho vài mẫu nhỏ canxicacbua vào ống nghiệm có nhánh chứa 1ml nước, đậy nhanh bằng nút có ống dẫn khí đầu vuốt nhọn. đốt khí sinh ra ở đầu ống vuốt nhọn.
Dẫn khí qua dung dịch KMnO4, dung dịch AgNO3 trong NH3, dung dịch Br2.
- Chú ý: Nên thực hiện phản ứng cộng trước rồi phản ứng cháy sau để đảm bảo không khí trong ống nghiệm đã bị đuổi hết hoàn toàn, tránh xảy ra nổ, nguy hiểm khi trong ống nghiệm còn không khí.
Video 3: Điều chế axetilen
Hiện tượng:
khí cháy sáng xanh ở đầu ống vuốt nhọn
KMnO4 bị mất màu tím
có kết tủa màu vàng
Giải thích:
Khí cháy sáng xanh ở đầu ống vuốt nhọn
KMnO4 bị mất màu tím (do C2H2 tạo ra phản ứng với KMnO4)
có kết tủa màu vàng (AgC≡CAg) xuất hiện
CaC2 + H2O → Ca(OH)2 + C2H2 ↑
Axetilen là hiđrocacbon không no nên làm mất màu dd brom. Khi cho C2H2 qua dd AgNO3 trong NH3 thấy có kết tủa vàng nhạt:
C2H2 + 2AgNO3 + 2NH3 → AgC≡CAg + 2NH4NO3
1. Kiến thức cần nắm
1.1. Thí nghiệm 1: Điều chế và thử tính chất của etilen
Hình 1: Thí nghiệm điều chế etilen
Etilen được điều chế từ ancol etylic theo phương trình:
C2H5OH 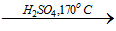
CH2=CH2 + Br2 → BrCH2 - CH2Br
1,2-đibrometan
1.2. Thí nghiệm 2: Điều chế và thử tính chất của axetilen
Hình 2: Điều chế axetilen
CaC2 + H2O → Ca(OH)2 + C2H2 ↑
C2H2 + 2AgNO3 + 2NH3 → AgC≡CAg + 2NH4NO3
2. Kĩ năng thí nghiệm
Không dùng tay cầm trực tiếp hoá chất.
Không đổ hoá chất này vào hoá chất khác ngoài chỉ dẫn.
Không đổ lại hoá chất thừa lại lọ đựng ban đầu.
Không dùng hoá chất nếu không biết hoá chất gì.
Không nếm hoặc ngửi trực tiếp hoá chất.
Khi mở lọ hoá chất và lấy hoá chất không để dây ra bàn, dùng xong đậy nắp lại ngay.
Trong 2 thí nghiệm trên khi dừng thí nghiệm phải tháo các ống nghiệm cẩn thận, đúng thứ tự các thao tác, tháo ống dẫn dd Ca(OH)2, dd Br2 trước sau đó mới tắt đèn cồn.
3. Thí nghiệm 1: Điều chế và thử tính chất của etilen
Cách tiến hành:
Cho vào ống nghiệm 1 ít cát sạch, cho tiếp vào ống nghiệm khoảng 2 ml C2H5OH khan, và chừng 4 ml H2SO4 đặc, lắc đều.
Đậy ống nghiệm bằng nút có ống dẫn khí bằng thủy tinh đầu vuốt nhọn. Kẹp ống nghiệm trên giá.
Dùng đèn cồn đun nóng đều ống nghiệm, sau đó tập trung đun phần chứa hóa chất đến khi hỗn hợp trong ống chuyển thành màu đen, có khí được tạo thành.
Đốt khí sinh ra ở đầu vuốt nhọn của ống dẫn khí, quan sát màu ngọn lửa.
Bông tẩm NaOH đặc có tác dụng giữu lại khí SO2, CO2 là những sản phẩm phụ được tạo thnàh do phản ứng của dd H2SO4 đặc với C2H5OH.
Dẫn khí C2H4 lần lượt vào ống nghiệm chứa dd Br2 và dd KMnO4
Video 1: Điều chế khí etylen
Video 2: Etilen tác dụng với dd KMnO4
Hiện tượng:
- Khí cháy sáng xanh ở đầu ống vuốt nhọn
- Brom bị mất màu nâu
- KMnO4 bị mất màu tím, xuất hiện kết tủa đen
Giải thích:
- Khí cháy sáng xanh ở đầu ống vuốt nhọn
- Brom bị mất màu nâu (do C2H4 tạo ra phản ứng với Br2)
- KMnO4 bị mất màu tím (do C2H4 tạo ra phản ứng với KMnO4, kết tủa đen sinh ra là MnO2)
- Etilen được điều chế từ ancol etylic theo phương trình:
C2H5OH 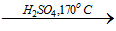
CH2=CH2 + Br2 → BrCH2 - CH2Br
1,2-đibrometan
4. Thí nghiệm 2: Điều chế và thử tính chất của axetilen
- Cách tiến hành:
Cho vài mẫu nhỏ canxicacbua vào ống nghiệm có nhánh chứa 1ml nước, đậy nhanh bằng nút có ống dẫn khí đầu vuốt nhọn. đốt khí sinh ra ở đầu ống vuốt nhọn.
Dẫn khí qua dung dịch KMnO4, dung dịch AgNO3 trong NH3, dung dịch Br2.
- Chú ý: Nên thực hiện phản ứng cộng trước rồi phản ứng cháy sau để đảm bảo không khí trong ống nghiệm đã bị đuổi hết hoàn toàn, tránh xảy ra nổ, nguy hiểm khi trong ống nghiệm còn không khí.
Video 3: Điều chế axetilen
Hiện tượng:
khí cháy sáng xanh ở đầu ống vuốt nhọn
KMnO4 bị mất màu tím
có kết tủa màu vàng
Giải thích:
Khí cháy sáng xanh ở đầu ống vuốt nhọn
KMnO4 bị mất màu tím (do C2H2 tạo ra phản ứng với KMnO4)
có kết tủa màu vàng (AgC≡CAg) xuất hiện
CaC2 + H2O → Ca(OH)2 + C2H2 ↑
Axetilen là hiđrocacbon không no nên làm mất màu dd brom. Khi cho C2H2 qua dd AgNO3 trong NH3 thấy có kết tủa vàng nhạt:
C2H2 + 2AgNO3 + 2NH3 → AgC≡CAg + 2NH4NO3
.PNG)
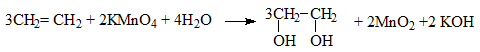
.PNG)