Bài 33: Luyện tập Ankin
1. Sự chuyển hóa lẫn nhau giữa ankan, anken, ankin
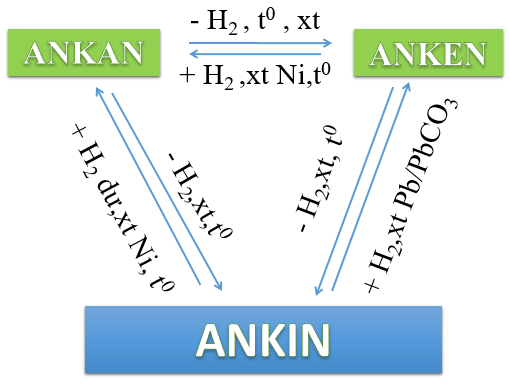
Hình 1: Sự chuyển hóa lẫn nhau giữa ankan, anken và ankin
Bài 1:
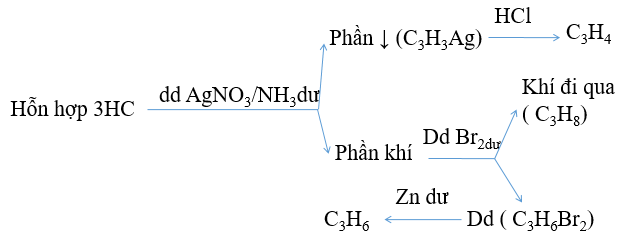
Có 3 lọ mất nhãn,chứa các hoá chất sau: Propan, propen, propin .
Hãy trình bày cách nhận biết các hoá chất trên bằng phương pháp hoá học.Viết các quá trình xảy ra.
Hướng dẫn:
Bài 2:
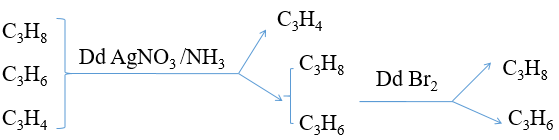
Cho hỗn hợp khí gồm 3 hiđrocacbon: propan, propin, propen. Trình bày phương pháp để tách biệt các khí đó ra khỏi nhau.
Hướng dẫn:
Bài 3:
Cho 27,2 gam ankin X tác dụng với 15,68 lít khí H2(đktc) có xúc tác thích hợp, thu được hỗn hợp Y ( không chứa H2).Biết Y phản ứng tối đa với dung dịch chứa gam Br2.Công thức phân tử của X là:
Hướng dẫn:
Ta có \(n_{H_{2}}=0,7mol;n_{Br_{2}}=0,1mol\)
\(C_{n}H_{2n-2}+2\bar{X_{2}}\rightarrow C_{n}H_{2n-2}\bar{X}_{4}\)
Ankin cộng với tác nhân X2 theo tỉ lệ 1:2
\(\Rightarrow n_{X}=\frac{n_{H_{2}}+n_{Br_{2}}}{2}=\frac{0,7+0,1}{2}=0,4mol\)
\(\Rightarrow M_{X}=\frac{27,2}{0,4}=68(C_{5}H_{8})\)
Bài 4:
Hỗn hợp X gồm axetilen và vinyl axetilen có tỉ khối so với hidro là 19,5. Lấy 4,48l X (đktc) trộn với 0,09mol H2 rồi cho vào bình kín có sẵn chất xúc tác Ni, đốt nóng, sau các phản ứng hoàn toàn thu được hỗn hợp Y chỉ gồm các hidrocacbon. Dẫn Y qua dung dịch chứa 0,2mol AgNO3 trong dung dịch NH3 dư, sau khi AgNO3 hết thu được 22,35g kết tủa và có 20,16l khí Z ở đktc thoát ra. Z phản ứng tối đa m gam brom trong CCl4 .Giá trị của m là:
Hướng dẫn:
MX= 39g; nX = 0,2 mol ⇒ Áp dụng qui tắc đường chéo:
\(n_{C_{{2}}H_{2}} = n_{C_{4}H_{4}}= 0,1 \ mol\)
⇒ npi(X) = 0,5 mol
Vì phản ứng hoàn toàn sau đó sản phẩm chỉ gồm hidrocacbon ⇒ H2 hết
⇒ nPi(Y) = mPi(X) – \(n_{H_{2}}\) = 0,41 mol; nY = nX = 0,2 mol
nZ = 0,9 mol
Giả sử Y gồm x mol C2H2 và y mol C4H4 dư và AgNO3 dư
⇒ x + y = nY – nZ = 0,11 mol
mkết tủa \(= m_{Ag_{2}C_{2}} + m_{C_{4}H_{3}Ag}\) = 240x + 159y = 22,35g
⇒ x = 0,06; y = 0,05 mol
\((2n_{C_{2}H_{2}} + n_{C_{4}H_{4}} = 0,17 < n_{AgNO_{3}} = 0,2 \Rightarrow TM)\)
⇒ npi(Z) = npi(Y) – \((2n_{C_{2}H_{2}} + 3n_{C_{4}H_{4}})\) = 0,14 mol = \(n_{Br_{2}}\)
⇒ m = 22,4g
1. Sự chuyển hóa lẫn nhau giữa ankan, anken, ankin
Hình 1: Sự chuyển hóa lẫn nhau giữa ankan, anken và ankin
Bài 1:
Có 3 lọ mất nhãn,chứa các hoá chất sau: Propan, propen, propin .
Hãy trình bày cách nhận biết các hoá chất trên bằng phương pháp hoá học.Viết các quá trình xảy ra.
Hướng dẫn:
Bài 2:
Cho hỗn hợp khí gồm 3 hiđrocacbon: propan, propin, propen. Trình bày phương pháp để tách biệt các khí đó ra khỏi nhau.
Hướng dẫn:
Bài 3:
Cho 27,2 gam ankin X tác dụng với 15,68 lít khí H2(đktc) có xúc tác thích hợp, thu được hỗn hợp Y ( không chứa H2).Biết Y phản ứng tối đa với dung dịch chứa gam Br2.Công thức phân tử của X là:
Hướng dẫn:
Ta có \(n_{H_{2}}=0,7mol;n_{Br_{2}}=0,1mol\)
\(C_{n}H_{2n-2}+2\bar{X_{2}}\rightarrow C_{n}H_{2n-2}\bar{X}_{4}\)
Ankin cộng với tác nhân X2 theo tỉ lệ 1:2
\(\Rightarrow n_{X}=\frac{n_{H_{2}}+n_{Br_{2}}}{2}=\frac{0,7+0,1}{2}=0,4mol\)
\(\Rightarrow M_{X}=\frac{27,2}{0,4}=68(C_{5}H_{8})\)
Bài 4:
Hỗn hợp X gồm axetilen và vinyl axetilen có tỉ khối so với hidro là 19,5. Lấy 4,48l X (đktc) trộn với 0,09mol H2 rồi cho vào bình kín có sẵn chất xúc tác Ni, đốt nóng, sau các phản ứng hoàn toàn thu được hỗn hợp Y chỉ gồm các hidrocacbon. Dẫn Y qua dung dịch chứa 0,2mol AgNO3 trong dung dịch NH3 dư, sau khi AgNO3 hết thu được 22,35g kết tủa và có 20,16l khí Z ở đktc thoát ra. Z phản ứng tối đa m gam brom trong CCl4 .Giá trị của m là:
Hướng dẫn:
MX= 39g; nX = 0,2 mol ⇒ Áp dụng qui tắc đường chéo:
\(n_{C_{{2}}H_{2}} = n_{C_{4}H_{4}}= 0,1 \ mol\)
⇒ npi(X) = 0,5 mol
Vì phản ứng hoàn toàn sau đó sản phẩm chỉ gồm hidrocacbon ⇒ H2 hết
⇒ nPi(Y) = mPi(X) – \(n_{H_{2}}\) = 0,41 mol; nY = nX = 0,2 mol
nZ = 0,9 mol
Giả sử Y gồm x mol C2H2 và y mol C4H4 dư và AgNO3 dư
⇒ x + y = nY – nZ = 0,11 mol
mkết tủa \(= m_{Ag_{2}C_{2}} + m_{C_{4}H_{3}Ag}\) = 240x + 159y = 22,35g
⇒ x = 0,06; y = 0,05 mol
\((2n_{C_{2}H_{2}} + n_{C_{4}H_{4}} = 0,17 < n_{AgNO_{3}} = 0,2 \Rightarrow TM)\)
⇒ npi(Z) = npi(Y) – \((2n_{C_{2}H_{2}} + 3n_{C_{4}H_{4}})\) = 0,14 mol = \(n_{Br_{2}}\)
⇒ m = 22,4g