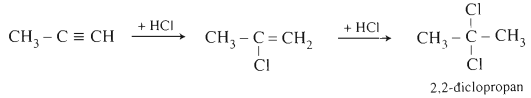Bài 32: Ankin
1. Đồng đẳng, đồng phân, danh pháp
Ankin: là những hidrocacbon mạch hở có 1 liên kết 3 (C≡C) trong phân tử.
1.1. Dãy đồng đẳng của ankin
Dãy đồng đẳng của ankin: C2H2, C3H4, … CnH2n-2 (n ≥2)
Công thức electron:
Công thức cấu tạo: \(H - C \equiv C - H\)
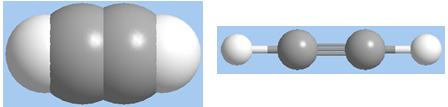
Hình 1: Mô hình phân tử axetilen dạng đặc và dạng rỗng
1.2. Đồng phân
Hai chất đầu dãy C2, C3 không có đồng phân ankin.
Các ankin từ C4 trở lên có đồng phân vị trí liên kết ba
Từ C5 còn có đồng phân mạch Cacbon (tương tự anken)
Ví dụ: Đồng phân C4H6
CH≡C−CH2−CH3: but-1-in (Etyl axetilen)
CH3−C≡C−CH3: but-2-in (Đimetyl axetilen)
Ví dụ: Đồng phân C5H8
CH≡C−CH2−CH2−CH3: pent-1-in (Propyl axetilen)
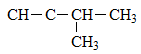
CH3−C≡C−CH2−CH3: pent-2-in (Etyl metyl axetilen)
1.3. Danh pháp
a) Tên thông thường
b) Tên thay thế:
Số chỉ vị trí-tên nhánh|tên mạch chính|-số chỉ vị trí-in
Các ankin có liên kết ba đầu mạch (dạng \(R - C \equiv CH\))
2. Tính chất vật lí
Ankin có nhiệt độ sôi tăng dần theo chiều tăng của phân tử khối.
Ankin có nhiệt độ sôi cao hơn và khối lượng riêng lớn hơn các anken tương ứng.
Các ankin không tan trong nước và nhẹ hơn nước.
3. Tính chất hóa học
Nguyên tử C của liên kết 3 ở trạng thái lai hoá sp (lai hoá phẳng) → (HCC) = 1800.
Liên kết 3 C≡C gồm 1 liên kết \(\sigma\) và 2 liên kết \(\pi\)
3.1. Phản ứng cộng
a. Cộng Hidro
Dùng Pb/PdCO3 hoặc Pd/BaSO4. Ankin chỉ cộng một phân tử hidro tạo anken.
CH≡CH + H2 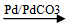
CH≡CH + 2H2 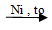
b. Cộng Br2:
c. Cộng HCl
CH≡CH + HCl 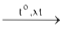
CHCl═CH2 +HCl 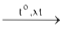
d. Cộng nước (hiđrat hoá)
CH≡CH + H2O 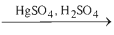
Lưu ý: Phản ứng cộng HX, H2O vào các ankin trong dãy đồng đẳng của axetilen cũng tuân theo quy tắc Maccopnhicop như anken.
e. Phản ứng đimehoá, trimehoá.
2 CH≡CH .PNG)
3 CH≡CH .PNG)
3.2. Phản ứng thế bằng ion kim loại
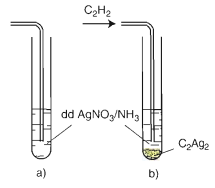
Hình 2: Phản ứng thế nguyên tử Hidro của C2H2 bằng ion bạc
a) trước khi sục khí C2H2
b) Sau khi sục khí C2H2
CH≡CH + 2AgNO3 + 2 NH3 → AgC≡CAg ↓vàng + 2 NH4NO3
Nguyên tử H đính với C mang liên kết 3 linh động hơn rất nhiều so với C liên kết đôi, đơn => nó có thế bởi ion KL.
Phản ứng này dùng để nhận biết các ankin 1 (có liên kết 3 ở đầu mạch)
RC≡CH + 2 AgNO3 + 2 NH3→ RC≡CAg + 2 NH4NO3
3.3. Phản ứng oxi hoá
a. Phản ứng oxi hoá hoàn toàn
2CnH2n-2 + (3n -1)O2 → 2n CO2 + 2(n-1) H2O
b. Phản ứng oxi hoá không hoàn toàn
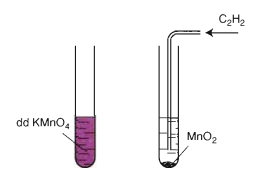
Mất màu KMnO4
Hình 3: Axetilen làm mất màu dd thuốc tím
4. Điều chế
4.1. Phòng thí nghiệm
CaC2 + H2O → Ca(OH)2 + C2H2 ↑
4.2. Công nghiệp
Đi từ dầu mỏ:
2 CH4 → C2H2 + 3 H2 (ĐK: 1500oC)
Đi từ đá vôi:
CaCO3 → CaO → CaC2 → C2H2
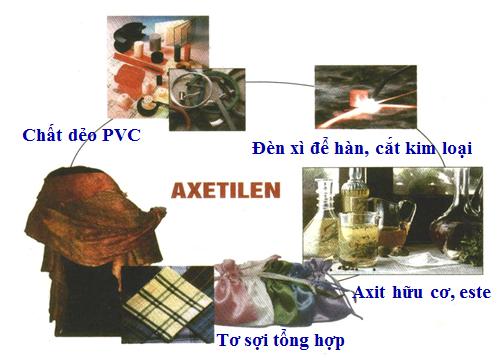
5. Ứng dụng
Dùng trong CN hàn cắt KL
Nguyên liệu tổng hợp chất hữu cơ cơ bản.
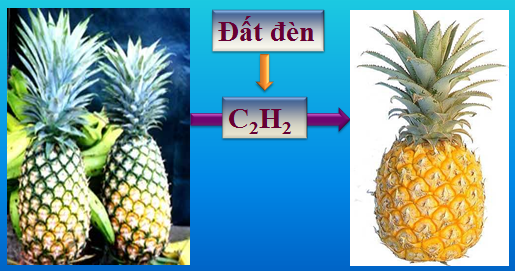
Hình 4: ứng dụng của axetilen
Hình 5: Đất đèn làm trái cây mau chín
Bài 1:
Khi điều chế axetilen bằng phương pháp nhiệt phân nhanh CH4 thu được hỗn hợp A gồm axetilen, hydro và một phần metan chưa phản ứng. Tỷ khối hơi cuả A so với hydro bằng 5. Hiệu suất chuyển hóa metan thành axetilen là:
Hướng dẫn:
Xét 1 mol CH4
2CH4 → C2H2 + 3H2
x → 0,5x → 1,5x mol
⇒ Sau phản ứng: nhh = 1 + x (mol)
Bảo toàn khối lượng: mtrước = msau
⇒ 16.1 = 5.2.(1 + x)
⇒ x = 0,6 mol
⇒ H% = 60%
Bài 2:
Một hidrocacbon X mạch thẳng có CTPT C6H6. Khi cho X tác dụng với dung dịch AgNO3/NH3 dư thu được hợp chất hữu cơ Y có MY - MX = 214 đvc. Xác định CTCT của X?
Hướng dẫn:
Vì X phản ứng với AgNO3/NH3 ⇒ X có nhóm -C ≡ CH đầu mạch
Công thức tổng quát: CxHy(C ≡ CH)n
CxHy(C ≡ CH)n → CxHy(C ≡ CAg)n
⇒ MY – MX = 107x = 214 ⇒ n = 2
Vì X mạch thẳng ⇒ X là CH ≡ C – CH2 – CH2 – C ≡ CH
Bài 3:
Nung nóng bình kín chứa 0,5 mol H2 và 0,3 mol ankin X (có bột Ni xúc tác), sau một thời gian thu được hỗn hợp Y. Tỉ khối của Y so với H2 bằng 16,25. Hỗn hợp Y phản ứng tối đa với 32 gam Br2 trong dung dịch. Công thức phân tử của X là:
Hướng dẫn:
\(n_{Br_{2}} = n_{pi(Y)}= 0,2 mol; \ n_{pi}\) (hh đầu) \(= 2n_{ankin} = 0,6 \ mol\)
⇒ \(n_{H_{2}}\) pứ \(=n_{pi}\) (hh đầu) \(- \ n_{pi(Y)} = 0,4 \ mol\)
⇒ sau phản ứng \(n_{Y} = n_{X} – n\) \(- n_{H_{2}}\) pứ \(= 0,5 + 0,3 - 0,4 = 0,4 \ mol\)
\(m_{X} = m_{Y} = M_{Y} \times n_{Y} = 16,25 \times 2 \times 0,4 = 13 \ g\)
⇒ \(m_{X}= 13 = 0,5 \times 2 + 0,3 \times M_{X}\)
⇒ \(M_{X} = 40 (C_{3}H_{4})\)
1. Đồng đẳng, đồng phân, danh pháp
Ankin: là những hidrocacbon mạch hở có 1 liên kết 3 (C≡C) trong phân tử.
1.1. Dãy đồng đẳng của ankin
Dãy đồng đẳng của ankin: C2H2, C3H4, … CnH2n-2 (n ≥2)
Công thức electron:
Công thức cấu tạo: \(H - C \equiv C - H\)
Hình 1: Mô hình phân tử axetilen dạng đặc và dạng rỗng
1.2. Đồng phân
Hai chất đầu dãy C2, C3 không có đồng phân ankin.
Các ankin từ C4 trở lên có đồng phân vị trí liên kết ba
Từ C5 còn có đồng phân mạch Cacbon (tương tự anken)
Ví dụ: Đồng phân C4H6
CH≡C−CH2−CH3: but-1-in (Etyl axetilen)
CH3−C≡C−CH3: but-2-in (Đimetyl axetilen)
Ví dụ: Đồng phân C5H8
CH≡C−CH2−CH2−CH3: pent-1-in (Propyl axetilen)
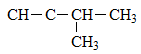
CH3−C≡C−CH2−CH3: pent-2-in (Etyl metyl axetilen)
1.3. Danh pháp
a) Tên thông thường
b) Tên thay thế:
Số chỉ vị trí-tên nhánh|tên mạch chính|-số chỉ vị trí-in
Các ankin có liên kết ba đầu mạch (dạng \(R - C \equiv CH\))
2. Tính chất vật lí
Ankin có nhiệt độ sôi tăng dần theo chiều tăng của phân tử khối.
Ankin có nhiệt độ sôi cao hơn và khối lượng riêng lớn hơn các anken tương ứng.
Các ankin không tan trong nước và nhẹ hơn nước.
3. Tính chất hóa học
Nguyên tử C của liên kết 3 ở trạng thái lai hoá sp (lai hoá phẳng) → (HCC) = 1800.
Liên kết 3 C≡C gồm 1 liên kết \(\sigma\) và 2 liên kết \(\pi\)
3.1. Phản ứng cộng
a. Cộng Hidro
Dùng Pb/PdCO3 hoặc Pd/BaSO4. Ankin chỉ cộng một phân tử hidro tạo anken.
CH≡CH + H2 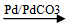
CH≡CH + 2H2 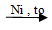
b. Cộng Br2:
c. Cộng HCl
CH≡CH + HCl 
CHCl═CH2 +HCl 
d. Cộng nước (hiđrat hoá)
CH≡CH + H2O 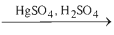
Lưu ý: Phản ứng cộng HX, H2O vào các ankin trong dãy đồng đẳng của axetilen cũng tuân theo quy tắc Maccopnhicop như anken.
e. Phản ứng đimehoá, trimehoá.
2 CH≡CH .PNG)
3 CH≡CH .PNG)
3.2. Phản ứng thế bằng ion kim loại
Hình 2: Phản ứng thế nguyên tử Hidro của C2H2 bằng ion bạc
a) trước khi sục khí C2H2
b) Sau khi sục khí C2H2
CH≡CH + 2AgNO3 + 2 NH3 → AgC≡CAg ↓vàng + 2 NH4NO3
Nguyên tử H đính với C mang liên kết 3 linh động hơn rất nhiều so với C liên kết đôi, đơn => nó có thế bởi ion KL.
Phản ứng này dùng để nhận biết các ankin 1 (có liên kết 3 ở đầu mạch)
RC≡CH + 2 AgNO3 + 2 NH3→ RC≡CAg + 2 NH4NO3
3.3. Phản ứng oxi hoá
a. Phản ứng oxi hoá hoàn toàn
2CnH2n-2 + (3n -1)O2 → 2n CO2 + 2(n-1) H2O
b. Phản ứng oxi hoá không hoàn toàn
Mất màu KMnO4
Hình 3: Axetilen làm mất màu dd thuốc tím
4. Điều chế
4.1. Phòng thí nghiệm
CaC2 + H2O → Ca(OH)2 + C2H2 ↑
4.2. Công nghiệp
Đi từ dầu mỏ:
2 CH4 → C2H2 + 3 H2 (ĐK: 1500oC)
Đi từ đá vôi:
CaCO3 → CaO → CaC2 → C2H2
5. Ứng dụng
Dùng trong CN hàn cắt KL
Nguyên liệu tổng hợp chất hữu cơ cơ bản.
Hình 4: ứng dụng của axetilen
Hình 5: Đất đèn làm trái cây mau chín
Bài 1:
Khi điều chế axetilen bằng phương pháp nhiệt phân nhanh CH4 thu được hỗn hợp A gồm axetilen, hydro và một phần metan chưa phản ứng. Tỷ khối hơi cuả A so với hydro bằng 5. Hiệu suất chuyển hóa metan thành axetilen là:
Hướng dẫn:
Xét 1 mol CH4
2CH4 → C2H2 + 3H2
x → 0,5x → 1,5x mol
⇒ Sau phản ứng: nhh = 1 + x (mol)
Bảo toàn khối lượng: mtrước = msau
⇒ 16.1 = 5.2.(1 + x)
⇒ x = 0,6 mol
⇒ H% = 60%
Bài 2:
Một hidrocacbon X mạch thẳng có CTPT C6H6. Khi cho X tác dụng với dung dịch AgNO3/NH3 dư thu được hợp chất hữu cơ Y có MY - MX = 214 đvc. Xác định CTCT của X?
Hướng dẫn:
Vì X phản ứng với AgNO3/NH3 ⇒ X có nhóm -C ≡ CH đầu mạch
Công thức tổng quát: CxHy(C ≡ CH)n
CxHy(C ≡ CH)n → CxHy(C ≡ CAg)n
⇒ MY – MX = 107x = 214 ⇒ n = 2
Vì X mạch thẳng ⇒ X là CH ≡ C – CH2 – CH2 – C ≡ CH
Bài 3:
Nung nóng bình kín chứa 0,5 mol H2 và 0,3 mol ankin X (có bột Ni xúc tác), sau một thời gian thu được hỗn hợp Y. Tỉ khối của Y so với H2 bằng 16,25. Hỗn hợp Y phản ứng tối đa với 32 gam Br2 trong dung dịch. Công thức phân tử của X là:
Hướng dẫn:
\(n_{Br_{2}} = n_{pi(Y)}= 0,2 mol; \ n_{pi}\) (hh đầu) \(= 2n_{ankin} = 0,6 \ mol\)
⇒ \(n_{H_{2}}\) pứ \(=n_{pi}\) (hh đầu) \(- \ n_{pi(Y)} = 0,4 \ mol\)
⇒ sau phản ứng \(n_{Y} = n_{X} – n\) \(- n_{H_{2}}\) pứ \(= 0,5 + 0,3 - 0,4 = 0,4 \ mol\)
\(m_{X} = m_{Y} = M_{Y} \times n_{Y} = 16,25 \times 2 \times 0,4 = 13 \ g\)
⇒ \(m_{X}= 13 = 0,5 \times 2 + 0,3 \times M_{X}\)
⇒ \(M_{X} = 40 (C_{3}H_{4})\)
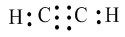
.PNG)