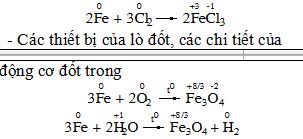Giáo án Hóa học lớp 12 bài 20: Sự ăn mòn kim loại
Giáo án môn Hóa học lớp 12
Giáo án Hóa học lớp 12 bài 20: Sự ăn mòn kim loại được TimDapAnsưu tầm và giới thiệu để có thể chuẩn bị giáo án và bài giảng hiệu quả, giúp quý thầy cô tiết kiệm thời gian và công sức làm việc. Giáo án môn Hóa học 12 này được soạn phù hợp quy định Bộ Giáo dục và nội dung súc tích giúp học sinh dễ dàng hiểu bài học hơn.
Giáo án Hóa học lớp 12 bài 17: Vị trí của kim loại trong bảng tuần hoàn và cấu tạo của kim loại
I. MỤC TIÊU BÀI HỌC
1. Kiến thức:
Hiểu được:
- Các khái niệm: ăn mòn kim loại, ăn mòn hoá học, ăn mòn điện hoá.
- Điều kiện xảy ra sự ăn mòn kim loại.
- Biết các biện pháp bảo vệ kim loại khỏi bị ăn mòn.
2. Kỹ năng:
- Phân biệt được ăn mòn hoá học và ăn mòn điện hoá ở một số hiện tượng thực tế.
- Sử dụng và bảo quản hợp lí một số đồ dùng bằng kim loại và hợp kim dựa vào những đặc tính của chúng
Trọng tâm: Ăn mòn điện hoá học.
3. Tư tưởng: Có ý thức bảo vệ kim loại, chống ăn mòn kim loại do hiểu rõ nguyên nhân và tác hại của hiện tượng ăn mòn kim loại
II. CHUẨN BỊ CỦA GIÁO VIÊN VÀ HỌC SINH
1. Giáo viên: Bảng phụ vẽ hình biểu diễn thí nghiệm ăn mòn điện hoá và cơ chế của sự ăn mòn điện hoá đối với sắt.
2. Học sinh: Đọc và làm bài trước khi đến lớp
III. PHƯƠNG PHÁP
Kết hợp khéo léo giữa đàm thoại, nêu vấn đề và hoạt động nhóm
IV. TIẾN TRÌNH BÀI GIẢNG
Tiết 31
1. Ổn định tổ chức:
2. Kiểm tra bài cũ:
Tính chất vật lí chung của kim loại biến đổi như thế nào khi chuyển thành hợp kim? Giải thích?
3. Bài mới:
|
Hoạt động của Giáo viên và Học sinh |
Nội dung ghi bảng |
|
* Hoạt động 1 - GV: Lấy ví dụ về các hiện tượng ăn mòn trong tự nhiên: Sắt bị han rỉ, thùng tôn bị han … Tất cả các hiện tượng đó là kim loại và hợp kim bị ăn mòn. Vậy ăn mòn KL là gì? Bản chất của ăn mòn kim loại là gì? HS: Trả lời |
I – KHáI NIỆM: -Ăn mòn KL: Sự ăn mòn kim loại là sự phá huỷ kim loại hoặc hợp kim do tác dụng của các chất trong môi trường xung quanh. -Bản chất: Kim loại bị oxi hoá thành ion dương M → Mn+ + ne |
|
* Hoạt động 2 - GV: nêu khái niệm về sự ăn mòn hoá học và lấy thí dụ minh hoạ. HS: Nghe và ghi TT
|
II – CáC DẠNG ĂN MòN 1. Ăn mòn hoá học: * Thí dụ: - Thanh sắt trong nhà máy sản xuất khí Cl2 * Ăn mòn hoá học là quá trình oxi hoá – khử, trong đó các electron của kim loại được chuyển trực tiếp đến các chất trong môi trường. |
|
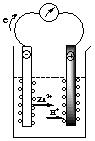
* Hoạt động 3 - GV: treo bảng phụ hình biểu diễn thí nghiệm ăn mòn điện hoá và yêu cầu HS nghiên cứu thí nghiệm về sự ăn mòn điện hoá. Yêu cầu HS nêu các hiện tượng và giải thích các hiện tượng đó: HS: Quan sát và giải thích hiện tượng
- GV: Ăn mòn như trên là ăn mòn điện hóa học hay còn gọi là ăn mòn điện hóa. Vậy ăn mòn điện hóa là gì? HS: Trả lời |
2. Ăn mòn điện hoá a) Khái niệm * Thí nghiệm: (SGK) * Hiện tượng: - Kim điện kế quay ð chứng tỏ có dòng điện chạy qua. - Thanh Zn bị mòn dần. - Bọt khí H2 thoát ra cả ở thanh Cu. * Giải thích: - Điện cực am (anot); Zn bị ăn mòn theo phản ứng: Zn → Zn2+ + 2e Ion Zn2+ đi vào dung dịch, các electron theo day dẫn sang điện cực Cu. - Điện cực dương (catot): ion H+ của dung dịch H2SO4 nhận electron biến thành nguyên tử H rồi thành phan tử H2 thoát ra. 2H+ + 2e → H2↑ * Ăn mòn điện hoá là quá trình oxi hoá – khử, trong đó kim loại bị ăn mòn do tác dụng của dung dịch chất điện li và tạo nên dòng electron chuyển dời từ cực am đến cực dương. |
|
* Hoạt động 4 - GV: treo bảng phụ về sự ăn mòn điện hoá học của hợp kim sắt. HS: Quan sát - GV: dẫn dắt HS xét cơ chế của quá trình gỉ sắt trong không khí ẩm. HS: Nghe TT |
b) Ăn mòn điện hoá học hợp kim sắt trong không khí ẩm Thí dụ: Sự ăn mòn gang trong không khí ẩm. - Trong không khí ẩm, trên bề mặt của gang luôn có một lớp nước rất mỏng đã hoà tan O2 và khí CO2, tạo thành dung dịch chất điện li. - Gang có thành phần chính là Fe và C cùng tiếp xúc với dung dịch đó tạo nên vô số các pin nhỏ mà sắt là anot và cacbon là catot. Tại anot: Fe → Fe2+ + 2e Các electron được giải phóng chuyển dịch đến catot. Tại catot: O2 + 2H2O + 4e → 4OH− Ion Fe2+ tan vào dung dịch chất điện li có hoà tan khí O2, Tại đay, ion Fe2+ tiếp tục bị oxi hoá, dưới tác dụng của ion OH− tạo ra gỉ sắt có thành phần chủ yếu là Fe2O3.nH2O. |
4. Củng cố bài giảng:
* Ăn mòn kim loại là gì? Có mấy dạng ăn mòn kim loại? Dạng nào xảy ra phổ biến hơn?
* Cơ chế của quá trình ăn mòn điện hoá?
5. Bài tập về nhà:
Bài tập: 1,2 trang 95 (SGK).