Đề số 4 - Đề kiểm tra học kì 1 - Hóa học 11
Đáp án và lời giải chi tiết Đề số 4 - Đề kiểm tra học kì 1 (Đề thi học kì 1) - Hóa học 11
Đề bài
I. TRẮC NGHIỆM KHÁCH QUAN (5 ĐIỂM)
Câu 1: Chất nào sau đây khi tan trong nước không phân li ra ion?
A. HCl
B. NaOH
C. NaCl
D. C2H5OH (rượu)
Câu 2: Chất điện li mạnh có độ điện li (α)
A. α = 0 B. α = 1
C. 0 < αD. α > 1
Câu 3: Dung dịch X có [H+] = 5.10-4. Dung dịch X có môi trường
A. axit B. bazơ
C. trung tính D. lưỡng tính
Câu 4: Khí N2 tương đối trơ về mặt hóa học ở nhiệt độ thường do nguyên nhân chính là
A. nitơ có bán kính nguyên tử nhỏ.
B. phân tử N2 không phân cực.
C. nitơ có độ âm điện lớn nhất trong nhóm VIA.
D. liên kết trong phân tử N2 là liên kết 3, không phân cực, có năng lượng lớn.
Câu 5: Để nhận biết ion PO43- trong dung dịch muối, người ta dùng thuốc thử là
A. dung dịch AgNO3
B. dung dịch NaOH
C. dung dịch HNO3
D. dung dịch Br2
Câu 6: Thành phần hóa học chính của phân lân supephotphat kép là
A. Ca3(PO4)2
B. Ca(H2PO4)2
C. CaHPO4
D. Ca(H2PO4)2 và CaSO4
Câu 7: Phân bón nào dưới đây có hàm lượng N cao nhất?
A. NH4Cl B. NH4NO3
C. Ca(NO3)2 D. (NH2)2CO
Câu 8: Khi cho 2 mol NaOH tác dụng hoàn toàn với 1 mol H3PO4 thì thu được muối là
A. NaH2PO4 B. Na2HPO4
C. Na3PO4 D. Na2H2PO4
Câu 9: Dung dịch nào sau đây làm quì tím chuyển sang màu đỏ?
A. NH4Cl B. NaOH
C. NaCl D. Na2CO3
Câu 10: Nhiệt phân hoàn toàn AgNO3 thu được sản phẩm là
A. Ag, NO2, O2
B. Ag2O, NO2, O2
C. AgNO2, O2
D. Ag, Ag2O, NO2
II. TỰ LUẬN (5 ĐIỂM)
Bài 1: Trộn 500 ml dung dịch HNO3 0,02M với 500 ml dung dịch NaOH 0,04M thu được dung dịch X. Tính pH của dung dịch X.
Bài 2: Hòa tan hoàn toàn 3,04 gam hỗn hợp X gồm (Fe, Cu) tác dụng hoàn toàn với dung dịch HNO3 loãng dư, sau phản ứng thu được 0,896 lít khí NO (sản phẩm khử duy nhất, ở đktc). Tính khối lượng mỗi kim loại trong hỗn hợp X?
Bài 3: Phản ứng của thuốc nổ đen: 2KNO3 + 3C + S .3CO2 + N2 + K2S; ΔH < 0
Tính phần trăm theo khối lượng các chất trong thuốc nổ đen, biết rằng thuốc nổ đen được trộn theo đúng tỉ lệ phản ứng. Khi đốt 1 kg thuốc nổ đen có thể tạo thành khối khí có thể tích bao nhiêu (ở 2730C và 1 atm).
Biết: Fe = 56, Cu = 64, C = 12, O = 16, N = 14
Lời giải chi tiết
ĐÁP ÁN
|
1. D |
2. B |
3. A |
4. D |
5. A |
|
6. B |
7. D |
8. B |
9. A |
10. A |
II. TỰ LUẬN (5,0 điểm)
Câu 1:
nH+ = nHNO3 = 0,02.0,5 = 0,01 mol
nOH- = nNaOH = 0,04.0,5 = 0,02 mol
H+ + OH- → H2O
Bđ: 0,01 0,02 (mol)
Pư: 0,01→0,01 (mol)
Sau: 0 0,01 (mol)
[OH-] = n/V = 0,01/(0,5 + 0,5) = 0,01M
=> pOH = -log[OH-] = -log(0,01) = 2
=> pH = 14 – pOH = 14 – 2 = 12
Vậy pH của dung dịch thu được sau phản ứng là 12.
Câu 2:
Cách 1: Viết và tính toán theo PTHH
Đặt x, y lần lượt là số mol của Fe và Cu
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
x → x (mol)
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
y → 2y/3 (mol)
- Khối lượng hỗn hợp: m hh = 56x + 64y = 3,04 (1)
- Số mol khí NO thu được: nNO = x + 2y/3 = 0,04 (2)
Giải (1) và (2) thu được x = 0,02 mol và y = 0,03 mol
Trong hỗn hợp ban đầu: mFe = 0,02.56 = 1,12 gam và mCu = 0,03.64 = 1,92 gam
Cách 2: Sử dụng định luật bảo toàn electron:
\(\eqalign{
& \mathop {Fe}\limits^0 - 3e \to \mathop {Fe}\limits^{ + 3} \,\,\,\,\,\,\,\,\,\mathop N\limits^{ + 5} + 2e\,\,\to \,\,\,\,\,\mathop N\limits^{ + 2}(NO) \cr
& x\, \to 3x\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,0,08 \leftarrow 0,04 \cr
& \mathop {Cu}\limits^0 - 2e \to \mathop {Cu}\limits^{ + 2} \cr
& y \to 2y \cr} \)
- Khối lượng hỗn hợp: m hh = 56x + 64y = 3,04 (1’)
- Định luật bảo toàn e: 3nFe + 2nCu = 3nNO => 3x + 2y = 3.0,04 (2’)
Giải (1’) và (2’) thu được x = 0,02 mol và y = 0,03 mol
Trong hỗn hợp ban đầu: mFe = 0,02.56 = 1,12 gam và mCu = 0,03.64 = 1,92 gam
Câu 3:
Hỗn hợp thuốc nổ đen gồm KNO3, C, S với tỉ lệ mol tương ứng là 2 : 3 : 1.
* Tính phần trăm theo khối lượng các chất trong thuốc nổ đen:

*Tính thể tích khí sinh ra khi đốt 1 kg thuốc nổ đen:
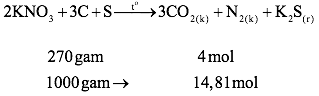
Thể tích khí thu được ở 273oC và p = 1 atm:
\({V_\text{khí}} = \dfrac{{nRT}}{ p} \)
\(= \dfrac{{14,81.0,082.(273 + 273)} }{ 1} \approx 663(l)\)
Xem lời giải chi tiết đề thi học kì 1 tại TimDapAn.com
Search google: "từ khóa + timdapan.com" Ví dụ: "Đề số 4 - Đề kiểm tra học kì 1 - Hóa học 11 timdapan.com"







