Bài 16: Hợp chất của cacbon
1. CACBON MONOXIT
1.1. Tính chất vật lý
- Là chất khí không màu, không mùi, không vị
- Hơi nhẹ hơn không khí, ít tan trong nước
- Hóa lỏng ở -191,50C, hóa rắn ở -205,50C, rất bền với nhiệt
- CO là khí rất độc
1.2. Tính chất hóa học
CO là oxít không tạo muối (oxít trung tính)
Ở tO thường, không tác dụng với H2O, axít, kiềm.
Tính khử
CO cháy trong oxi hoặc không khí: 2CO + O2 → 2CO2
Tác dụng với nhiều oxít kim loại (đứng sau Al)
3CO + Fe2O3 → 3CO2 + 2Fe
1.1.3. Điều chế
Trong Phòng thí nghiệm
HCOOH → CO + H2O (đk: H2SO4 đặc)
Trong công nghiệp
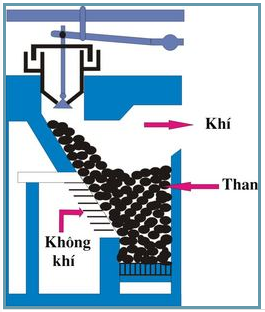
Hình 1: Sơ đồ lò gas
C + H2O .PNG)
CO2 + C → 2CO (khí than khô)
2. CACBON ĐIOXIT
2.1. Tính chất vật lý
- Chất khí, không màu, nặng gấp 1,5 lần không khí
- Tan không nhiều trong nước
- Ở trạng thái rắn, CO2 tạo thành một khối trắng gọi là "nước đá khô". Nước đá khô không nóng chảy mà thăng hoa, dùng để tạo môi trường lạnh, không có hơi ẩm.
2.2. Tính chất hóa học
CO2 là khí không duy trì sự sống và sự cháy.
CO2 là oxít axít
- Tan trong nước tạo H2CO3.
CO2(k) + H2O(l) → H2CO3 (dd).
- Tác dụng với dung dịch bazơ:
CO2 + Ca(OH)2 → CaCO3 + H2O (Nhận biết CO2)
2CO2 + Ca(OH)2 → Ca(HCO3)2
2.3. Điều chế
Trong Phòng thí nghiệm
CaCO3 +2HCl → CaCl2+CO2+ H2O.
Trong Công nghiệp
CaCO3 → CaO + CO2
3. AXIT CACBONIC VÀ MUỐI CACBONAT
3.1. Axít cacbonic
- H2CO3 là axít 2 nấc rất yếu, kém bền phân huỷ thành CO2 và H2O.
H2CO3 \(\leftrightarrows\)H+ + HCO3-
HCO3- \(\leftrightarrows\) H+ + CO3 2-
- Tác dụng với dd kiềm → muối
+ Trung hoà: Na2CO3, CaCO3…
+ Axít: NaHCO3, Ca(HCO3)2…
3.2. Muối cacbonat
Tính chất
- Tính tan
+ Muối cacbonat của kim loại kiềm, amoni và đa số các muối hidrocacbonat đều tan trong nước
+ Muối cacbonat của kim loại khác không tan trong nước
- Tác dụng với axít (Nhận biết muối cacbonat)
NaHCO3 + HCl → NaCl + CO2 + H2O
HCO3- + H+ →CO2 + H2O
Na2CO3 + 2HCl → NaCl+CO2 + H2O
CO32- + 2H+ → CO2 + H2O
Video 1: Phản ứng giữa NaHCO3 và dung dịch HCl
- Tác dụng với dd kiềm
Muối hidrocacbonat tác dụng với dd kiềm.
NaHCO3 + NaOH → Na2CO3 + H2O
HCO3- + OH- → CO32- + H2O
- Phản ứng nhiệt phân
Muối cacbonat tan: Không bị nhiệt phân.
Muối cacbonat ko tan → oxít kim loại + CO2.
VD: Mg CO3(r) → MgO(r) + CO2(k)
Muối hidrocacbonat → CO32- + CO2 + H2O.
VD: 2 NaHCO3(r) → Na2CO3(r) + CO2 + H2O
Video 2: Thí nghiệm nhiệt phân muối Natri hidrocacbonat
3.3. Ứng dụng
CaCO3 là chất bột màu trắng, nhẹ, được dùng làm chất độn trong một số ngành công nghiệp.
Bài 1:
Cho khí CO đi qua ống chứa 0,04 mol X gồm FeO và Fe2O3 đốt nóng, ta nhận được 4,784 gam chất rắn Y (gồm 4 chất), khí đi ra khỏi ống dẫn qua dung dịch Ba(OH)2 dư thì thu được 9,062 gam kết tủa. Phần trăm khối lượng FeO trong hỗn hợp X là:
Hướng dẫn:
\({n_{C{O_2}}} = {n_{BaC{O_3}}} = 0,046{\rm{ }}(mol)\)
Bảo toàn nguyên tố C ta có :
\({n_{CO}} = {n_{C{O_2}}} = 0,046(mol)\)
Bảo toàn khối lượng :
mhh + mCO = mY + mCO2 ⇒ mhh = 4,784 + 0,046.44 - 0,046.28 = 5,52 gam
Gọi số mol của FeO và Fe2O3 lần lượt là x và y :
\(\begin{array}{l}
\left\{ {\begin{array}{*{20}{l}}
{x + y = 0,04}\\
{72{\rm{x}} + 160y = 5,52}
\end{array}} \right.\\
\Leftrightarrow \left\{ {\begin{array}{*{20}{l}}
{x = 0,01(mol)}\\
{y = 0,03(mol)}
\end{array}} \right.
\end{array}\)
\(\% {m_{FeO}} = \frac{{0,01.72}}{{5,52}}.100 = 13,04\)
Bài 2:
Cho V lít hỗn hợp khí (ở đkc) gồm CO và H2 phản ứng với một lượng dư hỗn hợp rắn gồm CuO và Fe3O4 nung nóng. Sau khi các phản ứng xảy ra hoàn toàn, khối lượng hỗn hợp rắn giảm 0,48gam. Giá trị của V là
Hướng dẫn:
m chất rắn giảm = m hỗn hợp khí tăng
CO \(\overset{O^{2-}}{\rightarrow}\)CO2\(\nearrow\)
H2 \(\overset{O^{2-}}{\rightarrow}\) H2O\(\nearrow\)
1 mol hỗn hợp (CO, H2) phản ứng ⇒ m chất rắng giảm 16g
\(\Rightarrow\) n(CO, H2)phản ứng =\(\frac{16}{16}=1 mol\)
\(nO^{2-}=\frac{0,48}{16}=0,03\)
n(CO + H2)=0,03
V = 0,672 (lít)
1. CACBON MONOXIT
1.1. Tính chất vật lý
- Là chất khí không màu, không mùi, không vị
- Hơi nhẹ hơn không khí, ít tan trong nước
- Hóa lỏng ở -191,50C, hóa rắn ở -205,50C, rất bền với nhiệt
- CO là khí rất độc
1.2. Tính chất hóa học
CO là oxít không tạo muối (oxít trung tính)
Ở tO thường, không tác dụng với H2O, axít, kiềm.
Tính khử
CO cháy trong oxi hoặc không khí: 2CO + O2 → 2CO2
Tác dụng với nhiều oxít kim loại (đứng sau Al)
3CO + Fe2O3 → 3CO2 + 2Fe
1.1.3. Điều chế
Trong Phòng thí nghiệm
HCOOH → CO + H2O (đk: H2SO4 đặc)
Trong công nghiệp
Hình 1: Sơ đồ lò gas
C + H2O .PNG)
CO2 + C → 2CO (khí than khô)
2. CACBON ĐIOXIT
2.1. Tính chất vật lý
- Chất khí, không màu, nặng gấp 1,5 lần không khí
- Tan không nhiều trong nước
- Ở trạng thái rắn, CO2 tạo thành một khối trắng gọi là "nước đá khô". Nước đá khô không nóng chảy mà thăng hoa, dùng để tạo môi trường lạnh, không có hơi ẩm.
2.2. Tính chất hóa học
CO2 là khí không duy trì sự sống và sự cháy.
CO2 là oxít axít
- Tan trong nước tạo H2CO3.
CO2(k) + H2O(l) → H2CO3 (dd).
- Tác dụng với dung dịch bazơ:
CO2 + Ca(OH)2 → CaCO3 + H2O (Nhận biết CO2)
2CO2 + Ca(OH)2 → Ca(HCO3)2
2.3. Điều chế
Trong Phòng thí nghiệm
CaCO3 +2HCl → CaCl2+CO2+ H2O.
Trong Công nghiệp
CaCO3 → CaO + CO2
3. AXIT CACBONIC VÀ MUỐI CACBONAT
3.1. Axít cacbonic
- H2CO3 là axít 2 nấc rất yếu, kém bền phân huỷ thành CO2 và H2O.
H2CO3 \(\leftrightarrows\)H+ + HCO3-
HCO3- \(\leftrightarrows\) H+ + CO3 2-
- Tác dụng với dd kiềm → muối
+ Trung hoà: Na2CO3, CaCO3…
+ Axít: NaHCO3, Ca(HCO3)2…
3.2. Muối cacbonat
Tính chất
- Tính tan
+ Muối cacbonat của kim loại kiềm, amoni và đa số các muối hidrocacbonat đều tan trong nước
+ Muối cacbonat của kim loại khác không tan trong nước
- Tác dụng với axít (Nhận biết muối cacbonat)
NaHCO3 + HCl → NaCl + CO2 + H2O
HCO3- + H+ →CO2 + H2O
Na2CO3 + 2HCl → NaCl+CO2 + H2O
CO32- + 2H+ → CO2 + H2O
Video 1: Phản ứng giữa NaHCO3 và dung dịch HCl
- Tác dụng với dd kiềm
Muối hidrocacbonat tác dụng với dd kiềm.
NaHCO3 + NaOH → Na2CO3 + H2O
HCO3- + OH- → CO32- + H2O
- Phản ứng nhiệt phân
Muối cacbonat tan: Không bị nhiệt phân.
Muối cacbonat ko tan → oxít kim loại + CO2.
VD: Mg CO3(r) → MgO(r) + CO2(k)
Muối hidrocacbonat → CO32- + CO2 + H2O.
VD: 2 NaHCO3(r) → Na2CO3(r) + CO2 + H2O
Video 2: Thí nghiệm nhiệt phân muối Natri hidrocacbonat
3.3. Ứng dụng
CaCO3 là chất bột màu trắng, nhẹ, được dùng làm chất độn trong một số ngành công nghiệp.
Bài 1:
Cho khí CO đi qua ống chứa 0,04 mol X gồm FeO và Fe2O3 đốt nóng, ta nhận được 4,784 gam chất rắn Y (gồm 4 chất), khí đi ra khỏi ống dẫn qua dung dịch Ba(OH)2 dư thì thu được 9,062 gam kết tủa. Phần trăm khối lượng FeO trong hỗn hợp X là:
Hướng dẫn:
\({n_{C{O_2}}} = {n_{BaC{O_3}}} = 0,046{\rm{ }}(mol)\)
Bảo toàn nguyên tố C ta có :
\({n_{CO}} = {n_{C{O_2}}} = 0,046(mol)\)
Bảo toàn khối lượng :
mhh + mCO = mY + mCO2 ⇒ mhh = 4,784 + 0,046.44 - 0,046.28 = 5,52 gam
Gọi số mol của FeO và Fe2O3 lần lượt là x và y :
\(\begin{array}{l}
\left\{ {\begin{array}{*{20}{l}}
{x + y = 0,04}\\
{72{\rm{x}} + 160y = 5,52}
\end{array}} \right.\\
\Leftrightarrow \left\{ {\begin{array}{*{20}{l}}
{x = 0,01(mol)}\\
{y = 0,03(mol)}
\end{array}} \right.
\end{array}\)
\(\% {m_{FeO}} = \frac{{0,01.72}}{{5,52}}.100 = 13,04\)
Bài 2:
Cho V lít hỗn hợp khí (ở đkc) gồm CO và H2 phản ứng với một lượng dư hỗn hợp rắn gồm CuO và Fe3O4 nung nóng. Sau khi các phản ứng xảy ra hoàn toàn, khối lượng hỗn hợp rắn giảm 0,48gam. Giá trị của V là
Hướng dẫn:
m chất rắn giảm = m hỗn hợp khí tăng
CO \(\overset{O^{2-}}{\rightarrow}\)CO2\(\nearrow\)
H2 \(\overset{O^{2-}}{\rightarrow}\) H2O\(\nearrow\)
1 mol hỗn hợp (CO, H2) phản ứng ⇒ m chất rắng giảm 16g
\(\Rightarrow\) n(CO, H2)phản ứng =\(\frac{16}{16}=1 mol\)
\(nO^{2-}=\frac{0,48}{16}=0,03\)
n(CO + H2)=0,03
V = 0,672 (lít)