Bài 15: Cacbon
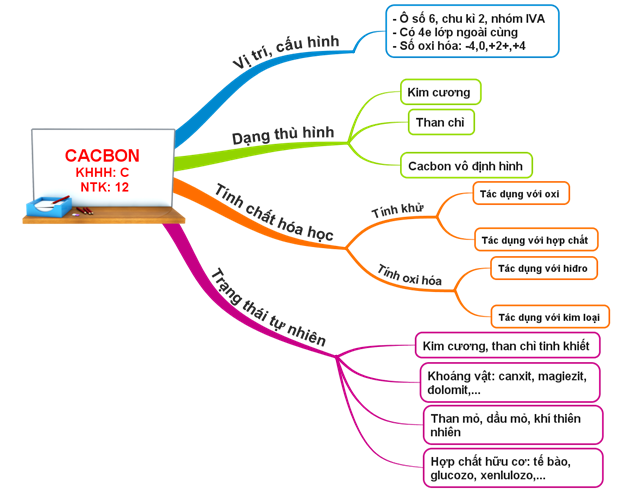
1. Vị trí và cấu hình electron nguyên tử
- Vị trí: Ô thứ 6, nhóm IVA, chu kì 2
- Cấu hình e: 1s2 2s2 2p2→ Có 4 e lớp ngoài cùng, tạo 4 liên kết cộng hoá trị
- Các số oxi hoá: -4, 0, +2 và +4
2. Tính chất vật lí
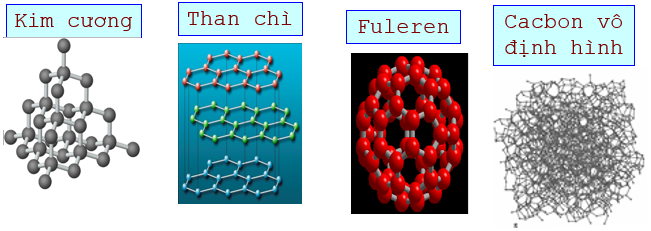
Hình 1: Cấu trúc tinh thể của Kim cương, than chì, Fulere và cacbon vô định hình
- Kim cương:
+ Cấu trúc: Tứ diện đều
+ Tính chất vật lý: Trong suốt, không màu, không dẫn điện, dẫn nhiệt kém
+ Ứng dụng: Đồ trang sức, mũi khoan, dao cắt thuỷ tinh...
- Than chì:
+ Cấu trúc: Cấu trúc lớp. Các lớp liên kết yếu với nhau
+ Tính chất vật lý: màu xám đen, dẫn điện tốt, mềm, các lớp dễ tách nhau
+ Ứng dụng: Làm điên cực, làm nồi nấu chảy các hợp kim chịu nhiệt, chế tạo chất bôi trơn, làm bút chì đen
- Cacbon vô định hình:
+ Cấu trúc: Xốp
+ Tính chất vật lý: Khả năng hấp phụ mạnh
+ Ứng dụng: Than cốc dùng làm chất khử trong luyện kim; than hoạt tính dùng trong mặt nạ phòng độc; Than muội dùng làm chất độn cao su, sản xuất mực in, xi đánh giày...
3. Tính chất hóa học
Cacbon vừa thể hiện tính khử vừa thể hiện tính oxi hoá
3.1. Tính khử
Tác dụng với oxi
Cacbon cháy trong không khí, toả nhiều nhiệt
C + O2 → CO2
Tác dụng với hợp chất
Ở nhiệt độ cao, cacbon khử được nhiều oxit, nhiều chất oxi hoá khác nhau
C + CO2 → 2CO
C + 4HNO3 (đặc) → CO2 + 4NO2 + 2H2O
3C + 2KClO3 → 2KCl + 3CO2
C + ZnO → Zn + CO
C + CuO → Cu + CO
Video 1: Cacbon khử Đồng (II) oxit tạo thành CO2 , khí CO2 làm đục nước vôi trong
3.2. Tính oxi hoá. Ở nhiệt độ cao
Tác dụng với hiđro
C + H2 → CH4
Tác dụng với kim loại
4Al + 3C → Al4C3 (Nhôm cacbua)
Ca + 2C → CaC2 (Canxi cacbua)
4. Trạng thái tự nhiên
Hình 2: Các dạng tồn tại của Cacbon
5. Tổng kết
Hình 3: Sơ đồ tư duy Bài Cacbon
1. Vị trí và cấu hình electron nguyên tử
- Vị trí: Ô thứ 6, nhóm IVA, chu kì 2
- Cấu hình e: 1s2 2s2 2p2→ Có 4 e lớp ngoài cùng, tạo 4 liên kết cộng hoá trị
- Các số oxi hoá: -4, 0, +2 và +4
2. Tính chất vật lí
Hình 1: Cấu trúc tinh thể của Kim cương, than chì, Fulere và cacbon vô định hình
- Kim cương:
+ Cấu trúc: Tứ diện đều
+ Tính chất vật lý: Trong suốt, không màu, không dẫn điện, dẫn nhiệt kém
+ Ứng dụng: Đồ trang sức, mũi khoan, dao cắt thuỷ tinh...
- Than chì:
+ Cấu trúc: Cấu trúc lớp. Các lớp liên kết yếu với nhau
+ Tính chất vật lý: màu xám đen, dẫn điện tốt, mềm, các lớp dễ tách nhau
+ Ứng dụng: Làm điên cực, làm nồi nấu chảy các hợp kim chịu nhiệt, chế tạo chất bôi trơn, làm bút chì đen
- Cacbon vô định hình:
+ Cấu trúc: Xốp
+ Tính chất vật lý: Khả năng hấp phụ mạnh
+ Ứng dụng: Than cốc dùng làm chất khử trong luyện kim; than hoạt tính dùng trong mặt nạ phòng độc; Than muội dùng làm chất độn cao su, sản xuất mực in, xi đánh giày...
3. Tính chất hóa học
Cacbon vừa thể hiện tính khử vừa thể hiện tính oxi hoá
3.1. Tính khử
Tác dụng với oxi
Cacbon cháy trong không khí, toả nhiều nhiệt
C + O2 → CO2
Tác dụng với hợp chất
Ở nhiệt độ cao, cacbon khử được nhiều oxit, nhiều chất oxi hoá khác nhau
C + CO2 → 2CO
C + 4HNO3 (đặc) → CO2 + 4NO2 + 2H2O
3C + 2KClO3 → 2KCl + 3CO2
C + ZnO → Zn + CO
C + CuO → Cu + CO
Video 1: Cacbon khử Đồng (II) oxit tạo thành CO2 , khí CO2 làm đục nước vôi trong
3.2. Tính oxi hoá. Ở nhiệt độ cao
Tác dụng với hiđro
C + H2 → CH4
Tác dụng với kim loại
4Al + 3C → Al4C3 (Nhôm cacbua)
Ca + 2C → CaC2 (Canxi cacbua)
4. Trạng thái tự nhiên
Hình 2: Các dạng tồn tại của Cacbon
5. Tổng kết
Hình 3: Sơ đồ tư duy Bài Cacbon