Đề thi cuối học kì 2 Hóa 8 nâng cao có đáp án
TimDapAngửi tới các bạn Bộ Đề thi lớp 8 cuối kì 2 năm 2023 môn Hóa học nâng cao có đáp án, được TimDapAnbiên soạn bám sát nội dung khung chương trình Hóa học 8 kì 2, bên cạnh đó bổ sung một số câu hỏi Nâng Cao giúp củng cố, mở rộng kiến thức, nhằm đánh giá được năng lực, khả năng vận dụng cao với đề thi kì 2 Hóa học lớp 8.
Bản quyền thuộc về TimDapAnnghiêm cấm mọi hành vi sao chép vì mục đích thương mại
Đề thi học kì 2 Hóa 8 nâng cao số 1
Phần 1. Trắc nghiệm (4 điểm)
Câu 1. Trộn 25ml rượu Etylic với 10ml nước cất. Câu nào sau đây diễn đạt đúng?
A. Chất tan là nước, dung môi là rượu.
B. Chất tan là rượu, dung môi là nước.
C. Nước hoặc rượu có thể là chất tan hoặc dung môi.
D. Cả hai chất rượu và nước vừa là nước vừa là dung môi.
Câu 2. Trong phòng thí nghiệm người ta điều chế O2 bằng cách nhiệt phân các hợp chất: KClO3 hoặc KMnO4, KNO3 vì các hóa chất này có đặc điểm.
A. Giàu oxi và dễ bị phân hủy ở nhiệt độ cao. B. Phù hợp với thiết bị hiện đại.
C. Dễ kiếm, rẻ tiền. D. Không độc hại.
Câu 3. Cho dãy chất sau: CO2, P2O5, CaCO3, SO3, Na2O, SiO2, CO, ZnO, PbO, N2O5, NO. Những chất nào là oxit axit?
A. CO2, CaCO3, SO3, Na2O, SiO2.
B. CO2, ZnO, P2O5, SO3, SiO2, NO.
C. CO2, SO3, CO, N2O5, PbO.
D. CO2, SO3, SiO2, N2O5, P2O5.
Câu 4. Độ tan của chất khí trong nước sẽ tăng nếu:
A. Giảm nhiệt độ vào giảm áp suất
B. Tăng nhiệt độ vào giảm áp suất
C. Giảm nhiệt độ vào tăng áp suất
D. Tăng nhiệt độ vào tăng áp suất
Câu 5. Nồng độ mol của dung dịch thu được khi cho 8,19 gam NaCl vào 200 ml nước là:
A. 0,7M B. 0,8M C. 0,9M D. 1M
Câu 6. Nồng độ % của dung dịch là:
A. số mol chất tan trong 1 lít dung dịch
B. số gam chất tan trong 100g dung dịch.
C. số gam chất tan trong 1 lít dung dịch.
D. số gam chất tan trong 100g nước.
Câu 7. Hòa tan 20g muối vào 180g nước, nồng độ % của dung dịch ở 15oC là:
A. 12%. B. 6%. C. 10%. D. 8%.
Câu 8. Dãy oxit nào có tất cả các oxit đều tác dụng được với nước?
A. SO3, CaO, CuO, Fe2O3.
B. ZnO, CO2, SiO2, PbO.
C. SO2, Al2O3, HgO, K2O.
D. SO3, Na2O, CaO, P2O5.
Câu 9. Dung dịch là hỗn hợp
A. chất rắn trong chất lỏng.
B. đồng nhất của dung môi và chất tan.
C. đồng nhất của các chất rắn, lỏng, khí trong dung môi.
D. đồng nhất chất rắn và dung môi .
Câu 10. Trong các nhóm sau nhóm nào tác dụng được với nước ở nhiệt độ thường
A. K, Ca, Fe C. Na, K, Ca
B. Fe, Cu, K D. Zn, Ca, Na
Phần 2. Tự luận (6 điểm )
Câu 1. (2 điểm) Hòan thành các sơ đồ phản ứng sau:
a) Al + H2SO4 (l) - - > ? + ?
b) ? + H2O - - > KOH
c) Fe2O3 + H2 - -> ? + H2O.
d) Fe + ? - - > FeCl3.
e) FexOy + HCl - - > ? + H2O.
Câu 2. (1,5 điểm) Bằng phương pháp hóa học, hãy nhận biết 3 lọ mất nhãn đựng riêng biệt các chất sau: CaO, SO2, NaO
Câu 3. (2,5 điểm) Hòa tan hoàn toàn 4,8g kim loại magie vào dung dịch axit clohiđric HCl 14,5%.
a) Viết PTHH của phản ứng.
b) Tính số gam muối magie clorua MgCl2 tạo thành và thể tích khí H2 sinh ra ở đktc
c) Tính khối lượng dung dịch axit clohiđric 14,5% đã dùng?
(Biết: Mg = 24, Zn = 65, Cl = 35.5 , H = 1; O = 16)
Đáp án đề kiểm thi cuối kì 2 môn Hóa học nâng cao lớp 8
Phần 1. Trắc nghiệm (4 điểm)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| A | A | D | C | A | B | C | D | D | C |
Phần 2. Tự luận (6 điểm)
Câu 1. (2 điểm)
a) 2Al + 3H2SO4 (l) Al2(SO4)3 + 3H2.
b) K2O + H2O 2KOH
c) Fe2O3 + 3H2 2Fe + 3H2O.
d) 2Fe + 3Cl2 2FeCl3.
e) FexOy + 2yHCl FeCl2y/x + yH2O.
Câu 2. (1,5 điểm)
Trích mẫu thuốc thử ra ống nghiệm rồi đánh số thứ tự.
Nhỏ từ từ nước vào các ống nghiệm, sau đó dùng quỳ tím nhúng vào dung dịch. Ống nghiệm nào quỳ chuyển sang màu đỏ axit HCl, ống nghiệm quỳ chuyển sang màu xanh là Na2O và CaO
Na2O + H2O 2NaOH
CaO + H2O Ca(OH)2
Sục khí CO2 vào 2 ống nghiệm còn lại, ống nghiệm nào có kết tủa trắng là CaO
Ca(OH)2 + CO2 CaCO3 ↓ + H2O
NaOH + CO2 Na2CO3 + H2O
Ống nghiệm còn lại là Na2O
Câu 3. (2,5 điểm)
a) Mg + 2HCl MgCl2 + H2
b)
Số mol của Mg = 0,2 (mol)
=> Số mol H2 =0,2 (mol) => Thể tích H2 = 0,2 x 22,4 = 4,48 l
c)
nHCl = 0,4 mol => mHCl = 0,4 x 36,5 = 14,6g
Xem chi tiết đề thi và đáp án tại đây: Đề thi lớp 8 cuối kì 2 môn Hóa học nâng cao (số 1)
Đề thi học kì 2 Hóa 8 nâng cao số 2
Phần 1. Trắc nghiệm (4 điểm)
Câu 1. Dung dịch muối ăn 8% là:
A. Dung dịch có 8 phần khối lượng muối ăn và 100 phần khối lượng nước.
B. Dung dịch có 8 phần khối lượng muối ăn và 92 ml nước .
C. Dung dịch có 8 phần khối lượng muối ăn và 92 phần khối lượng nước.
D. Dung dịch có 8 phần khối lượng nước và 92 phần khối lượng muối ăn.
Câu 2. Cho các khí: CO, N2, O2, Cl2, H2. Các khí nhẹ hơn không khí là:
A. N2, H2, CO
B. N2, O2, Cl2
C. CO, Cl2
D. Cl2,O2
Câu 3. Cho dãy chất sau: BaO, P2O5, CaCO3, ZnO, Fe2O3, SiO2, CO, FeO, PbO, N2O5, K2O. Những chất nào là oxit bazơ?
A. BaO, CaCO3, K2O, Na2O, SiO2
B. BaO, ZnO, FeO, PbO, SiO2, K2O
C. BaO, SO3, FeO, N2O5, PbO
D. BaO, ZnO, K2O, PbO, FeO
Câu 4. Ứng dụng của hiđro là:
A. Dùng làm nguyên liệu cho động cơ xe lửa
B. Dùng làm chất khử để điều chế một số kim loại từ oxit của chúng
C. Dùng để bơm vào khinh khí cầu
D. Tất cả các ứng dụng trên
Câu 5. Với một lượng chất tan xác định khi tăng thể tích dung môi thì:
A. C% tăng, CM tăng
B. C% giảm, CM giảm
C. C% tăng, CM giảm
D. C% giảm, CM tăng
Câu 6. Khi tăng nhiệt độ thì độ tan của chất rắn trong nước thay đổi như thé nào?
A. Đều tăng
B. Đều giảm
C. Phần lớn tăng
D. Phần lớn giảm
Câu 7. Hòa tan 5,85 gam NaCl vào 2 lít dung dịch, nồng độ mol/l của dung dịch ở thu được là:
A. 0,5M
B. 0,25M
C. 0,15M
D. 0,05M
Câu 8. Dãy oxit nào có tất cả các oxit đều tác dụng được với nước?
A. SO3, CaO, CuO, Fe2O3
B. ZnO, CO2, SiO2, PbO
C. SO2, Al2O3, HgO, K2O
D. SO3, Na2O, CaO, P2O5
Câu 9. Phản ứng nào sau đây là phản ứng thế
A. 4P + 5O2 P2O5
B. S + O2 SO2
C. 2KClO3 2KCl + 3O2
D. Zn + 2HCl ZnCl2 + H2
Câu 10. Trong các cặp chất sau, cặp chất nào đều được dùng để điều chế oxi trong phòng thí nghiệm.
A. H2O, KClO3
B. Zn, KClO3
C. KMnO4, KClO3
D. KMnO4, CaCO3
Phần 2. Tự luận (6 điểm )
Câu 1. (1.5 điểm) Cho các phương trình hóa học sau
a) ? + 2O2 Fe3O4
b) H2 + CuO Cu + ?
c) ?H2O ? + O2
d) ?Al + ?HCl 2AlCl3 + ?
Hãy hoàn thành và phân loại các phản ứng trên?
Câu 2. (1.5 điểm)
Cho các chất H2O, N2O5, O2, C2H2, Ca. Từ các chất này hãy chọn và viết phương trình điều chế các sản phẩm sau: HNO3, CaO, H2, CO2.
Câu 3. (3 điểm)
Cho 3,25 gam Kẽm tác dụng hết với dung dịch axit Clohiđric tạo ra Kẽm clorua ZnCl2 và khí hiđro.
a) Viết phương trình hóa học của phản ứng?
b) Tính thể tích dung dịch axit clohiđric 0.5M đã phản ứng ?
c) Cho một hỗn hợp gồm nhôm và sắt tác dụng hết với dung dịch H2SO4 thấy thoát ra khí Hiđro đúng bằng lượng Hiđro thu được ở phản ứng trên. Tính thành phần phần trăm theo khối lượng mỗi kim loại trong hỗn hợp, biết số mol của hai kim loại này trong hỗn hợp bằng nhau ?
(Biết: Mg = 24, Zn = 65, Cl = 35.5 , H = 1; O = 16)
Đáp án đề kiểm thi cuối kì 2 môn Hóa học nâng cao lớp 8
Phần 1. Trắc nghiệm (4 điểm)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| C | A | A | D | B | A | D | D | D | C |
Phần 2. Tự luận (6 điểm)
Câu 1. (1,5 điểm)
a) 3Fe + 2O2 2Fe3O4
b) H2 + CuO Cu + H2O
c) 2H2O 2H2 + O2
d) 2Al + 6HCl 2AlCl3 + 3H2
Câu 2. (1,5 điểm)
N2O5 + H2O 2HNO3
Ca + O2 CaO
CaO + H2O H2 + Ca(OH)2
O2 + C2H2 2CO2 + H2O
Câu 3. (3 điểm)
a/ Zn + 2HCl ZnCl2 + H2
b/
Số mol của Zn = 0,2 (mol)
=> Số mol HCl =0,4 (mol)
c/
Gọi số mol của Al và Fe lần lượt là x, y
Số mol của hidro là 0,2 mol
2Al + 3H2SO4 → Al2(SO4)3 + 3H2 (1)
x → 3x/2
Fe + H2SO4 → FeSO4 + H2 (2)
y → y
Theo đề bài ta có: nAl = nFe => x = y
3x/2 + y = 0,2 mol
Giải phương trình ta được: x = y =0,08 mol
% mAl = (0,08 x 27) : (0,08 x 27 + 0,08 x 56) x 100 = 32,53%
=> %mFe = 100% - 32,53% = 67,47%
Xem chi tiết đề thi và đáp án tại đây: Đề thi Hóa học kì 2 lớp 8 - Đề nâng cao số 2
Đề kiểm tra học kì 2 Hóa 8 nâng cao số 3
Phần 1. Trắc nghiệm (3 điểm)
Câu 1. Thao tác thí nghiệm nào sau đây đúng và an toàn nhất?
A. Đốt khí hidro vừa điều chế
B. Thử độ tinh khiết của hidro trước khi đốt
C. Chờ khí hidro thoát ra khỏi một thời gian mới đốt
D. Đốt khí hidro khi nào cũng được
Câu 2. Oxit nào là oxit axit trong số các oxit kim loại cho dưới đây?
A. Li2O
B. MgO
C. CrO3
D.Cr2O3
Câu 3. Khi thổi không khí vào nước nguyên chất, dung dịch thu được hơi có tính axit. Khí nào sau đây gây nên tính axit đó?
A. CO2
B. H2
C. N2
D. O2
Câu 4. Hợp chất nào sau đây là bazơ?
A. Đồng (II) nitrat
B. Kali clorua
C. Sắt (III) sunfat
D. Canxi hidroxit
Câu 5. Công thức nào sau đây biểu diễn đúng mối quan hệ C% và CM
A.
B.
C.
D.
Câu 6. Khi giảm nhiệt độ thì độ tan của chất rắn trong nước thay đổi như thé nào?
A. Đều tăng
B. Đều giảm
C. Phần lớn tăng
D. Phần lớn giảm
Câu 7. Ở 20oC, 300g nước hòa tan tối đa 264g muối kali nitrat (KNO3). Độ tan của muối này là:
A. 44 gam
B. 50 gam
C. 88 gam
D. 100 gam
Câu 8. Dùng tính tan hãy lựa chọn câu trả lời đúng trong các câu sau:
Dãy các chất tan được trong nước
A. KOH, CuSO4, H2SO4, MgSO4
B. NaCl, MgCl2, Ba(NO3)2, Fe(OH)3
C. NaOH, HNO3, BaCO3, Al(OH)3
D. FeCl3, KNO3, HCl, Na2CO3
Câu 9. Phản ứng nào sau đây là phản ứng thế
A. 4P + 5O2 P2O5
B. CaO + H2O → Ca(OH)2
C. 2KClO3 2KCl + 3O2
D. Mg + 2HCl → MgCl2 + H2
Câu 10. Cặp chất nào sau đây khi tan trong nước chúng tác dụng với nhau tạo ra chất khí bay ra?
A. BaCl2 và H2SO4
B. NaCl và Na2SO3
C. HCl và Na2CO3
D. AlCl3 và H2SO4
Phần 2. Tự luận (7 điểm )
Câu 1 (2 điểm) Hoàn thành chuỗi phản ứng hóa học sau
KMnO4 → O2 → SO2 → SO3 → H2SO4 → Na2SO4
Câu 2. (1.5điểm)
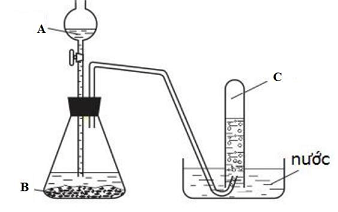
- Hình vẽ trên mô tả thí nghiệm nào đã được học?
- Cho biết tên gọi và công thức hóa học lần lượt các chất A,B,C
- Viết phương trình hóa học của thí nghiệm trên
Câu 3. (2,5 điểm) Khử 50 gam hỗn hợp đồng (II) oxit và sắt (III) oxit bằng khí hidro. Biết trong hỗn đồng (II) oxit chiếm 20% về khối lượng. Hãy tính:
a) Thể tích khí hidro ở đktc?
b) Tính khối lượng bazo thu được sau phản ứng.
Câu 4. (1 điểm) Nung 2,45 gam một chất hóa học M thấy thoát ra 672ml khí O2 (đktc). Phần rắn còn lại chứa 52,35% Kali và 47,65% Clo (về khối lượng). Tìm công thức của chất hóa học M.
(Biết: Mg = 24, Zn = 65, Cl = 35.5 , H = 1; O = 16, Cu= 64, Fe = 56)
Xem đáp án tại đây: Đề thi Hóa học kì 2 lớp 8 - Đề nâng cao số 3
Đề thi học kì 2 Hóa 8 nâng cao số 4
Phần 1. Trắc nghiệm (4 điểm)
Câu 1. Công thức tính khối lượng D
A.
B.
C.
D.
Câu 2. Oxit kim loại nào dưới đây là oxit axit?
A. MnO2
B. Cu2O
C. CuO
D. Mn2O7
Câu 3. Cho dãy chất sau: Mn2O7, P2O5, SO3, ZnO, Fe2O3, SiO2, CO, FeO, CrO3, N2O5, K2O. Những chất nào là oxit axit?
A. Mn2O7, SO3, K2O, Na2O, SiO2.
B. Mn2O7, ZnO, FeO, CrO3, SiO2.
C. Mn2O7, SO3, SiO2, N2O5, CrO3.
D. Mn2O7, ZnO, K2O, CrO3, FeO
Câu 4. Oxit nào góp phần nhiều vào sự hình thành hiệu ứng nhà kính?
A. CO2
B. CO
C. SO2
D. SnO2
Câu 5. Phương pháp nào sau đây có thể dùng điều chế đồng (II) sunfat:
A. Thêm dung dịch Natri sunfat vào dung dịch đồng (II) clorua
B. Thêm dung dịch axit sunfuaric loãng vào đồng (II) cacbonat
C. Cho đồng kim loại vào dung dịch natri sunfat
D. Cho luồng khí lưu huỳnh đioxit đi qua bột đồng nóng
Câu 6. Một oxit trong đó cứ 12 phần khối lượng lưu huỳnh có 18 khối lượng oxi. Công thức hóa học của oxit là:
A. SO2
B. SO3
C. S2O
D. S2O3
Câu 7. Hòa tan 5,85 gam NaCl vào 2 lít dung dịch, nồng độ mol/l của dung dịch ở thu được là:
A. 0,5M
B. 0,25M
C. 0,15M
D. 0,05M
Câu 8. Cặp chất nào nhau đây khi tan trong nước chúng tác dụng với nhau tạo ra chất khí bay ra?
A. BaCl2 và H2SO4
B. NaCl và Na2SO3
C. HCl và Na2CO3
D. AlCl3 và H2SO4
Câu 9. Phản ứng nào sau đây là phản ứng thế
A. 4P + 5O2 2P2O5
B. Ca(OH)2 + CO2 → CaCO3 + H2O
C. Fe2O3 + 3CO → 3CO2 + 2Fe
D. Zn + H2SO4 → ZnSO4 + H2
Câu 10. Cho các oxit sau: CaO, CuO, SO3, CO, CO2, Na2O, SO3, NO2, P2O5, SO2. Những chất tác dụng với nước tạo thành dung dịch axit
A. CaO, CO, CO2, Na2O, SO3.
B. CuO, SO3, CO, CO2, SO3.
C. SO3, CO2, NO2, P2O5, SO2.
D. SO3, CO, NO2, P2O5, SO2.
Phần 2. Tự luận (6 điểm )
Câu 1 (2 điểm) Hoàn thành sơ đồ phản ứng sau:
Na → Na2O → NaOH → Fe(OH)3 → Fe2O3 → Fe → FeCl2
Câu 2. (1,5 điểm) Bằng phương pháp hóa học nhận biết 4 dung dịch mấy nhãn đựng trong các lọ mất nhãn sau: NaOH, H2SO4, NaCl, Ba(OH)2
Câu 3. (2,5 điểm) Hòa tan hoàn toàn 22 gam hỗn hợp X gồm Al và Fe trong dung dịch H2SO4 dư sau phản ứng thu được 17,92 lít khí H2 (đktc) và dung dịch Y.
a) Tính thành phần % về khối lượng mỗi kim loại trong X
b) Cho dung dịch Y tác dụng với NaOH dư thu được m gam kết tủa. Viết phương trình hóa học và tính số gam kết tủa
( Biết: Na = 23, Al = 27, Fe = 56, H = 1; O = 16, S= 32, Mg)
Xem đáp án tại đây: Đề thi Hóa học kì 2 lớp 8 - Đề nâng cao số 4
...............................
Để mang đến cho các em học sinh nguồn tài liệu ôn thi học kì 2 lớp 8 môn Hóa, bên cạnh các đề thi học kì 2 cơ bản, TimDapAnbiên soạn những đề thi nâng cao dành cho các bạn học sinh có học lực khá giỏi để thử sức và ôn luyện, đây cũng là tài liệu hay cho các bạn học sinh lớp chuyên ôn thi môn Hóa hiệu quả hơn. Để có thêm các đề ôn thi khác, mời các em vào chuyên mục Đề thi học kì 2 lớp 8 và Đề thi học kì 2 lớp 8 môn Hóa trên TimDapAnđể ôn luyện nhé.
Ngoài ra, Tìm Đáp Án đã thành lập group chia sẻ tài liệu học tập THCS miễn phí trên Facebook: Tài liệu học tập lớp 8. Mời các bạn học sinh tham gia nhóm, để có thể nhận được những tài liệu mới nhất.