Đề số 3 - Đề kiểm tra học kì 1 - Hóa học 10
Đáp án và lời giải chi tiết Đề số 3 - Đề kiểm tra học kì 1 (Đề thi học kì 1) - Hóa học 10
Đề bài
I. TRẮC NGHIỆM (30 CÂU – 7.5Đ)
Câu 1: Trong một nhóm A của bảng tuần hoàn, đi từ trên xuống dưới thì điều khẳng định đúng là:
A. Bán kính nguyên tử giảm dần
B. Độ âm điện tăng dần
C. Bán kính nguyên tử tăng dần
D. Tính kim loại giảm dần
Câu 2: Sắt là yếu tố quan trọng cấu tạo nên Hemoglobin, một dạng protein là thành phần chính tạo nên hồng cầu. Chính sắt có trong hemoglobin làm nên màu đỏ của máu, một thành phần quan trọng của cơ thể.Cấu hình electron của 26Fe là
A. 1s22s22p63s23p64s23d6
B. 1s22s22p63s23p63d84s2
C. 1s22s22p63s23p63d10
D. 1s22s22p63s23p63d64s2
Câu 3: Cho 3,2 gam hỗn hợp hai kim loại X và Y thuộc hai chu kì liên tiếp của nhóm IIA tác dụng hết với dung dịch HCl dư thu được 2,24 lít khí hiđro (đktc). X và Y là
A. Be và Mg B. Mg và Ca
C. B và Al D. Na và Rb
Câu 4: Bo là nguyên tố dinh dưỡng thiết yếu đối với cây trồng. Ngày nay trên 70 quốc gia đã được phát hiện tình trạng thiếu Bo ở hầu hết các loại cây trên nhiều loại đất. Phân Bo cũng đã được sử dụng rộng rãi trên thế giới. Trong tự nhiên, Bo có 2 đồng vị . Biết chiếm 18,8%. Khối lượng nguyên tử trung bình của bo là 10,812. Số khối của đồng vi ̣thứ 2 là
A. 12. B. 10.
C. 9. D. 11.
Câu 5: Cho phản ứng: Cu + HNO3 → Cu(NO3)2 + NO + H2O. Sau khi cân bằng, tổng hệ số cân bằng tối giản các chất sản phẩm trong phản ứng là
A. 11 B. 16
C. 9 D. 20
Câu 6: Dãy sắp xếp các nguyên tử theo chiều bán kính giảm dần là (Mg (Z=12), S (Z=16), Cl (Z=17), F (Z=9)).
A. Mg > S > Cl > F
B. F > Cl > S > Mg
C. S > Mg > Cl > F
D. Cl > F > S > Mg
Câu 7: Nguyên tố hoá học là những nguyên tử có cùng
A. số proton và nơtron.
B. số nơtron.
C. số khối.
D. số proton.
Câu 8: Mỗi nhóm A và B bao gồm loại nguyên tố nào ?
A. s và f – d và p
B. s và d – p và f
C. d và f – s và p
D. s và p – d và f
Câu 9: Trong phản ứng đốt cháy CuFeS2 tạo ra sản phẩm CuO, Fe2O3 và SO2 thì một phân tử CuFeS2 sẽ
A. nhường 12 electron.
B. nhận 13 electron
C. nhận 12 electron.
D. nhường 13 electron.
Câu 10: Số oxi hoá của nguyên tố nitơ trong các hợp chất : NH4Cl, HNO3, NO, NO2, N2, N2O lần lượt...
A. –4, +6, +2, +4, 0, +1.
B. 4, +5, –2, 0, +3, –1.
C. +3, –5, +2, –4, –3, –1.
D. –3, +5, +2, +4, 0, +1.
Câu 11: Cation R+ có cấu tạo như hình. Vị trí của R trong bảng tuần hoàn là
A. chu kì 3, nhóm VIIA
B. chu kì 3, nhóm IA
C. chu kì 4, nhóm IA
D. chu kì 3, nhóm VIA
Câu 12: Trong số các phản ứng sau, phản ứng nào là phản ứng oxi hóa - khử ?
A. HNO3 + NaOH → NaNO3 + H2O
B. N2O5 + H2O → 2HNO3
C. 2HNO3 + 3H2S → 3S + 2NO + 4H2O
D. 2Fe(OH)3 → Fe2O3 + 3H2O
Câu 13: Trong phân tử sẽ có liên kết cộng hoá trị phân cực nếu cặp electron chung...
A. ở giữa hai nguyên tử.
B. lệch về một phía của một nguyên tử.
C. chuyển hẳn về một nguyên tử.
D. nhường hẳn về một nguyên tử.
Câu 14: Cho các nguyên tố: X (Z= 11), Y (Z= 17). Liên kết hoá học giữa X và Y thuộc loại...
A. liên kết kim loại.
B. liên kết ion.
C. liên kết cộng hoá trị có cực.
D. liên kết cộng hoá trị không có cực.
Câu 15: Hòa tan hoàn toàn 20,0 gam hỗn hợp hai kim loại đều đứng trước hiđro trong dãy hoạt động hóa học trong dung dịch HCl dư thấy thoát ra 4,48 lít khí H2 (đktc). Cô cạn dung dịch sau phản ứng thu được m gam muối khan. Giá trị của m là
A. 40g B. 34,2g
C. 26,8g D. 24,8g
Câu 16: Hoà tan 16 gam CuSO4 vào nước được 500ml dung dịch CuSO4. Cho dần dần mạt sắt vào 500 ml dung dịch trên, khuấy nhẹ cho tới khi dung dịch hết màu xanh thì lượng mạt sắt đã dùng là
A. 5,6g. B. 13,6g.
C. 12,9g. D. 11,2g.
Câu 17: Nước đá khô thường được dùng để làm lạnh, giữ lạnh nhằm vận chuyển và bảo quản các sản phẩm dễ hư hỏng vì nhiệt độ. Nước đá khô được dùng nhiều trong các ngành công nghiệp thực phẩm, thủy hải sản và còn được dùng để bảo quản vắc xin, dược phẩm trong ngành Y tế – dược phẩm. Thành phần nước đá khô là CO2, hãy chỉ ra nội dung sai.
A. Liên kết giữa nguyên tử oxi và cacbon là phân cực
B. Trong phân tử có hai liên kết đôi
C. Phân tử CO2 không phân cực
D. Phân tử có cấu tạo góc
Câu 18: Cho các nguyên tố với số hiệu nguyên tử sau: X (Z = 1); Y (Z = 7); E (Z = 12); T (Z = 19). Dãy gồm các nguyên tố kim loại là:
A. X, Y, E. B. X, Y, E, T.
C. E, T. D. Y, T.
Câu 19: Trong phản ứng : Cl2 + 2KBr → Br2 + 2KCl, nguyên tố clo…
A. chỉ bị khử.
B. không bị oxi hóa, không bị khử.
C. chỉ bị oxi hóa.
D. vừa bị oxi hóa, vừa bị khử.
Câu 20: Tổng số các haṭ trong nguyên tử của nguyên tố R là 114. Số hạt mang điện nhiều hơn số hạt không mang điện là 26 hạt. Số khối của R là
A. 144. B. 79.
C. 44. D. 35.
Câu 21: Trong tự nhiên Gali có 2 đồng vị là 69Ga (60,1%) và 71Ga (39,9%). Nguyên tử khối trung bình của Gali là
A. 71,20 B. 70
C. 69,80 D. 70,20
Câu 22: Cho 1,82 g một kim loại kiềm tác dụng hết với 48,44 gam nước, sau phản ứng thu được 2,912 lít khí H2 (đktc) và dung dịch X. Kim loại kiềm và nồng độ phần trăm dung dịch X là
A. Li; 44%.
B. Na; 31,65 %.
C. Li; 12,48 %.
D. Na; 44%.
Câu 23: Các hạt cấu tạo của hầu hết các nguyên tử là...
A. proton, nơtron và electron.
B. proton, nơtron.
C. proton và electron.
D. nơtron và electron.
Câu 24: Cho 3,9g một kim loại kiềm, tác dụng hết với dung dịch HCl dư thu được 1,12 lit khí hiđro (ở đktc). Kim loại đó là
A. Mg B. Na
C. K D. Li
Câu 25: Hình vẽ sau mô tả thí nghiệm điều chế khí Z:
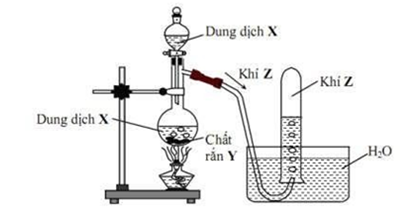
Phương trình hóa học điều chế khí Z là
A. Ca(OH)2dd + 2NH4Clr →2NH3 +CaCl2 +2H2O
B. 2HCl +Zn→ZnCl2 +H2
C. H2SO4 đặc +Na2SO3 →SO2 +Na2SO4 +H2O
D. 4HCl +MnO2→Cl2 +MnCl2 +2H2O
Câu 26: Lưu huỳnh là một phi kim phổ biến, không mùi, không vị, nhiều hóa trị. Lưu huỳnh, trong dạng gốc của nó là chất rắn kết tinh màu vàng chanh. Trong tự nhiên, nó có thể tìm thấy ở dạng đơn chất hay trong các khoáng chất sulfua và sulfat. Nó là một nguyên tố thiết yếu cho sự sống và được tìm thấy trong hai axít amin. Sử dụng thương mại của nó chủ yếu trong các phân bón nhưng cũng được dùng rộng rãi trong thuốc súng, diêm, thuốc trừ sâu và thuốc diệt nấm. Trong phản ứng hóa học, 1 nguyên tử lưu huỳnh (S) chuyển thành ion sunfua (S2–) bằng cách :
A. nhường đi hai electron.
B. nhận thêm hai electron.
C. nhường đi một electron.
D. nhận thêm một electron.
Câu 27: Nhóm nguyên tố là tập hợp các nguyên tố mà nguyên tử của chúng có cùng…
A. số lớp electron
B. số electron ở lớp ngoài cùng
C. số electron
D. số electron hóa trị
Câu 28: Hợp chất khí với H của nguyên tố Y là YH4 . Oxit cao nhất của nó chứa 46,67%Y về khối lượng. Y là
A. Na B. C
C. S D. Si
Câu 29: Nguyên tử của nguyên tố R có cấu hình electron 1s22s22p3, công thức hợp chất khí với hiđro và công thức oxit cao nhất là
A. RH2, RO
B. RH3, R2O5
C. RH5, R2O3
D. RH4, RO2
Câu 30: Độ âm điện của một nguyên tử là...
A. khả năng hai chất phản ứng với nhau mạnh hay yếu.
B. khả năng nhường electron ở lớp ngoài cùng cho nguyên tử khác.
C. đặc trưng cho khả năng hút electron của nguyên tử đó khi hình thành liên kết hóa học.
D. khả năng nhận electron để trở thành anion.
II. TỰ LUẬN (2.5Đ)
Câu 1(1đ) Thực hành thí nghiệm : nhỏ từng giọt dung dịch KMnO4 loãng vào ống nghiệm đựng dung dịch hỗn hợp FeSO4 và H2SO4 loãng, lắc nhẹ. Nêu hiện tượng xảy ra, viết và cân bằng phương trình hóa học để giải thích và cho biết vai trò của từng chất, trong phản ứng.
Câu 2(0,5đ) Nguyên tử clo có độ âm điện (3,16) nhỏ hơn độ âm điện của nguyên tử oxi (3,44); nhưng đơn chất clo hoạt động hóa học mạnh hơn đơn chất oxi. Giải thích ngắn gọn.
Câu 3(1đ) Ngâm một vật bằng đồng có khối lượng 4,24 gam vào 80 ml dung dịch AgNO3 CM. Phản ứng kết thúc lấy vật đồng ra khỏi dung dịch, rửa nhẹ, sấy khô; cân nặng 5 gam. Tính CM.
Lời giải chi tiết
|
1 |
2 |
3 |
4 |
5 |
|
C |
D |
B |
D |
C |
|
6 |
7 |
8 |
9 |
10 |
|
A |
D |
D |
D |
D |
|
11 |
12 |
13 |
14 |
15 |
|
B |
C |
B |
B |
B |
|
16 |
17 |
18 |
19 |
20 |
|
A |
D |
C |
C |
B |
|
21 |
22 |
23 |
24 |
25 |
|
C |
C |
A |
C |
B |
|
26 |
27 |
28 |
29 |
30 |
|
B |
B |
D |
D |
B |
II. TỰ LUẬN (2.5Đ)
Câu 1:
Hiện tượng: Dung dịch thuốc tím bị nhạt màu dần.
PTHH:
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O
\(\mathop {Fe}\limits^{ + 2} - 1e \to \mathop {Fe}\limits^{ + 3} \) => FeSO4 là chất khử
\(\mathop {Mn}\limits^{ + 7} + 5e \to \mathop {Mn}\limits^{ + 2} \)=> KMnO4 là chất oxi hóa
Câu 2:
Phân tử O2: O=O
Phân tử Cl2: Cl-Cl
Liên kết đôi ở phân tử O2 bền hơn liên kết đơn ở Cl2 nên O2 kém hoạt động hơn Cl2.
Câu 3:
m KL tăng = 5 – 4,24 = 0,76 gam
PTHH:
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
PƯ: 1 2 1 2 (mol) => m KL tăng = 108.2 – 64 = 152 (g)
ĐB: 0,005 ← 0,01 ← 0,005 ← 0,01 <= m KL tăng = 0,76 (g)
=> CM dd AgNO3 = n/V = 0,01 : 0,08 = 0,125M
Search google: "từ khóa + timdapan.com" Ví dụ: "Đề số 3 - Đề kiểm tra học kì 1 - Hóa học 10 timdapan.com"







