Đề thi giữa kì 1 Hóa 10 Cánh diều - Đề số 4
Cấu hình electron nào sau đây là của nguyên tố phi kim ? Các đồng vị được phân biệt bởi yếu tố nào sau đây?: Cho m gam kim loại Na tác dụng với dung dịch HCl dư. Sau phản ứng thu được 6,72 lít H2 (đktc). Giá trị m là
Đề bài
I. Trắc nghiệm (5 điểm)
Câu 1: Số proton và số neutron trong hạt nhân nguyên tử \({}_{80}^{201}X\)là:
A. 201; 80. B. 121; 80. C. 80; 201. D. 80; 121.
Câu 2: Cấu hình electron nào sau đây là của nguyên tố phi kim ?
A. 1s22s1. B. 1s22s22p6.
C. 1s2. D. 1s22s22p63s23p5.
Câu 3: Cho các nguyên tử: \({}_6^{12}X,{}_7^{14}Y,{}_6^{14}Z,{}_{14}^{28}T\). Các nguyên tử nào là đồng vị của cùng một nguyên tố hóa học?
A. X và Z. B. Y và Z. C. T và Z. D. Y, Z,T.
Câu 4: Cho kí hiệu nguyên tử \({}_{19}^{39}K\). Phát biểu đúng là
A. Trong hạt nhân có 38 hạt mang điện.
B. Số hiệu nguyên tử là 39.
C. Số neutron trong hạt nhân hơn số proton là 2.
D. Có lớp electron ngoài cùng là N.
Câu 5: Các đồng vị được phân biệt bởi yếu tố nào sau đây?
A. Số electron hoá trị. B. Số neutron.
C. Số proton. D. Số lớp electron.
Câu 6: Cho m gam kim loại Na tác dụng với dung dịch HCl dư. Sau phản ứng thu được 6,72 lít H2 (đktc). Giá trị m là
A. 4,5. B. 13,5. C. 2,7. D. 13,8.
Câu 7: Nguyên tử khối trung bình của nguyên tố Br là 79,91; R có 2 đồng vị là \({}^{79}Br;{}^{{A_1}}Br\). Biết \({}^{79}Br\)chiếm 54,5 %. Số khối A1 của đồng vị thứu 2 có giá trị là:
A. 80. B. 82. C. 81. D. 85
Câu 8: Một nguyên tử X có 26 electron. Khi mất 2 electron, cấu hình electron của ion X2+ là
A. (Ar)3d44s2
B. (Ar)3d54s1
C. (Ar)3d6
D. (Ar)3d5
Câu 9: Cấu hình electron của nguyên tố X là 1s22s22p63s23p64s2. Phát biểu sai là
A. Lớp N có 2e. B. Lớp K có 2e.
C. Lớp L có 8e. D. Lớp M có 6e.
Câu 10: Ở trạng thái cơ bản, nguyên tử của những nguyên tố nào dưới đây có 3 electron độc thân?
A. Boron
B. Oxygen
C. Phosphorus
D. Chlorine
II. Tự luận (5 điểm)
Câu 1 (2 điểm) Nguyên tử A có số neutron nhiều hơn số proton là 1 và số hạt mang điện nhiều hơn số hạt không mang điện là 10.
a) Viết cấu hình electron của A, xác định kim loại? phi kim hay khí hiếm?
b) Biểu diễn cấu hình orbital nguyên tử lớp ngoài cùng và xác định số electron độc thân của A.
Câu 2 (3 điểm) Nguyên tử Mg có ba đồng vị ứng với thành phần phần trăm về số nguyên tử như sau :
|
Đồng vị |
24Mg |
25Mg |
26Mg |
|
% |
78,6 |
10,1 |
11,3 |
a. Tính nguyên tử khối trung bình của Mg.
b. Giả sử trong hỗn hợp nói trên có 50 nguyên tử 25Mg, thì số nguyên tử tương ứng của hai đồng vị còn lại là bao nhiêu ?
-------- Hết --------
Đáp án
I. Trắc nghiệm:
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
D |
D |
A |
D |
C |
D |
C |
C |
D |
A |
Lời giải chi tiết
Câu 1:
Phương pháp:
Kí hiệu hóa học biểu diễn: \({}_Z^AX\)
Lời giải chi tiết
\({}_{80}^{201}X\)-> A = 201 và Z = P = E = 80
-> N = A – P = 208 – 80 = 121
Đáp án D
Câu 2:
Phương pháp giải:
Nguyên tố phi kim có 5, 6, 7 electron lớp ngoài cùng
Lời giải chi tiết
A có 1 electron lớp ngoài cùng
B có 8 electron lớp ngoài cùng
C có 2 electron lớp ngoài cùng
D có 7 electron lớp ngoài cùng -> phi kim
Đáp án D
Câu 3:
Phương pháp giải:
Đồng vị là tập hợp các nguyên tử có cùng số hiệu nguyên tử nhưng khác nhau về số neutron
Lời giải chi tiết
Z và X có cùng số hiệu nguyên tử là 6
-> Đáp án A
Câu 4:
\({}_{19}^{39}K\) -> Z = P = E = 19
-> N = A – P = 39 – 19 = 20
Cấu hình electron: 1s22s22p63s23p64s1
A sai vì trong hạt nhân hạt mang điện là proton bằng 19
B sai vì số hiệu nguyên tử bằng Z = 19
C sai vì hạt neutron hơn proton là 1
D đúng vì lớp N có n = 4
-> Đáp án D
Câu 5:
Phương pháp giải:
Đồng vị gồm các nguyên tử có cùng số hiệu nguyên tử nhưng khác nhau về số neutron
Lời giải chi tiết
Đáp án C
Câu 6:
\({n_{{H_2}}} = \frac{{6,72}}{{22,4}} = 0,3\)(mol)
PTHH: 2Na + 2HCl → 2NaCl + H2
-> \({n_X} = 2{n_{{H_2}}} = 0,3.2 = 0,6\)(mol)
-> mNa = 0,6.23 = 13,8 g
-> Đáp án D
Câu 7:
Phương pháp giải:
Áp dụng CT tính nguyên tử khối trung bình
\(\overline {{A_X}} = \frac{{{a_1}{A_1} + {a_2}{A_2} + ... + {a_i}{A_i}}}{{100}}\)
\(\overline {{A_X}} \)là nguyên tử khối trung bình của X
Ai là nguyên tử khối đồng vị thứ i
ai là tỉ lệ % số nguyên tử đồng vị thứ i
Lời giải chi tiết:
Áp dụng CT tính nguyên tử khối trung bình
\(\begin{array}{l}\overline {{A_{Br}}} = \frac{{79.54,5 + {A_1}.45,5}}{{100}} = 79,91\\ = > {A_1} = 81\end{array}\)
-> Đáp án C
Câu 8:
X có 26 electron
-> Cấu hình electron: (Ar)3d64s2
Khi mất 2 electron, nguyên tử X sẽ bớt ở lớp ngoài cùng trước
-> Cấu hình của ion X2+ là: (Ar)3d6
-> Đáp án C
Câu 9:
A đúng lớp N (n=4) có 2 electron
B đúng lớp K (n = 1) có 2 electron
C đúng lớp L (n = 2) có 8 electron
D sai lớp M (n = 3) có 8 electron
-> Đáp án D
Câu 10:
Lời giải chi tiết:
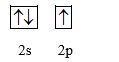
a) Boron
B (Z = 5): 1s22s22p1
Cấu hình orbital lớp ngoài cùng:
-> B có 1 electron độc thân
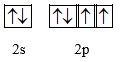
b) Oxygen
O (Z = 8): 1s22s22p4
Cấu hình orbital lớp ngoài cùng:
-> O có 2 electron độc thân
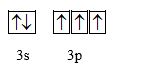
c) Phosphorus
P (Z = 15): (Ne) 3s23p3
Cấu hình orbital lớp ngoài cùng:
-> P có 3 electron độc thân
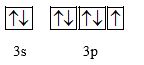
d) Chlorine
Cl (Z = 17): (Ne) 3s23p5
Cấu hình orbital lớp ngoài cùng:
-> Cl có 1 electron độc thân
-> đáp án A
II. Tự luận:
Câu 1:
Gọi P, N, E lần lượt là số proton, neutron và electron của A cần tìm
Số neutron nhiều hơn số proton là 1
→ N – P = 1 (1)
Số hạt mang điện nhiều hơn số hạt không mang điện là 10.
→ P + E – N = 10 (2)
Mà P = E (3)
Từ (1), (2) và (3), giải hệ phương trình => P = E = 11 và N = 12
a) Cấu hình electron của A : 1s22s22p63s1
-> A là (Sodium)
A có 1 electron lớp ngoài cùng -> A là kim loại
b)
-> A có 1 electron độc thân
Câu 2:
Phương pháp giải:
Áp dụng CT tính nguyên tử khối trung bình
\(\overline {{A_X}} = \frac{{{a_1}{A_1} + {a_2}{A_2} + ... + {a_i}{A_i}}}{{100}}\)
\(\overline {{A_X}} \)là nguyên tử khối trung bình của X
Ai là nguyên tử khối đồng vị thứ i
ai là tỉ lệ % số nguyên tử đồng vị thứ i
Lời giải chi tiết:
a) Áp dụng CT tính nguyên tử khối trung bình
\(\overline {{A_{Mg}}} = \frac{{24.78,6 + 25.10,1 + 11,3.26}}{{100}} = 24,33\)
b) Số nguyên tử 24Mg: \(\frac{{78,6}}{{10,1}}.50 = 389\)(nguyên tử)
Số nguyên tử 26Mg: \(\frac{{11,3}}{{10,1}}.50 = 56\)(nguyên tử)
Search google: "từ khóa + timdapan.com" Ví dụ: "Đề thi giữa kì 1 Hóa 10 Cánh diều - Đề số 4 timdapan.com"