Đề thi giữa kì 1 Hóa 10 Cánh diều - Đề số 10
Nguyên tử X có cấu hình e 1s2 2s2 2p5 thì ion tạo ra từ X có khả năng tồn tại độc lập sẽ có cấu hình electron nào sau đây:
Đề thi
I. TRẮC NGHIỆM
Câu 1: Nguyên tử X có cấu hình e 1s2 2s2 2p5 thì ion tạo ra từ X có khả năng tồn tại độc lập sẽ có cấu hình electron nào sau đây:
A. 1s2 2s2 2p4 B. 1s2 2s2 2p6 3s2 C. 1s2 2s2 2p6 D. 1s2 2s2
Câu 2: Nguyên tố Y có Z=27. Vị trí của nguyên tố Y trong bảng hệ thống tuần hoàn là :
A. Chu kì 4, nhóm VIIB B. Chu kì 4, nhóm IIB
C. Chu kì 4, nhóm VIIIB D. Chu kì 4, nhóm IIA
Câu 3: Cho biết nguyên tố A ở ô thứ 16, chu kì 3, nhóm VIA. Cấu hình electron của A là:
A. 1s22s22p63s23p5 B. 1s22s22p63s23p7 C. 1s22s22p63s23p6 D. 1s22s22p63s23p4
Câu 4: Phát biểu nào sau đây không đúng? Trong bảng hệ thống tuần hoàn, các nguyên tố:
A. được sắp xếp theo chiều tăng dần điện tích hạt nhân.
B. có cùng số lớp electron trong nguyên tử được xếp thành một hàng.
C. có cùng số electron ở lớp vỏ ngoài cùng được xếp thành một cột.
D. được chia thành 8 nhóm, mỗi nhóm gồm 8 - 18 nguyên tố.
Câu 5: Nguyên tử của nguyên tố Aluminium có 13 electron. Kết luận nào sau đây đúng?

. Nguyên tử Aluminium
A. Lớp electron ngoài cùng của Aluminium có 3e.
B. Lớp electron ngoài cùng của Aluminium có 1e.
C. Lớp L (lớp thứ 2) của Aluminium có 6e.
D. Lớp L (lớp thứ 2) của Aluminium có 3e hay nói cách khác là lớp electron ngoài cùng của Aluminium có 3e.
Câu 6: Cho cấu hình electron nguyên tử của các nguyên tố sau:
X. 1s2 2s2 2p6 3s2; Y. 1s2 2s2 2p6 3s2 3p6 4s1;
Z. 1s2 2s2 2p6 3s2 3p3; T. 1s2 2s2 2p6 3s2 3p6 3d8 4s2.
Dãy cấu hình electron của các nguyên tử nguyên tố kim loại là
A. X, Y, Z. B. X, Y, T. C. Y, Z, T. D. X, Z, T.
|
Câu 7: \({}_{92}^{235}U\,\)là nguyên liệu quan trọng của ngành công nghiệp hạt nhân tuy nhiên hàm lượng \({}_{92}^{235}U\)trong tự nhiên rất thấp. Việc làm "giàu" \({}_{92}^{235}U\,\)luôn thu hút sự quan tâm của cộng đồng quốc tế. Phát biểu nào sau đây về \({}_{92}^{235}U\,\)là đúng?
|
Nhà máy hạt nhân |
A. \({}_{92}^{235}U\,\) và \({}_{92}^{238}U\,\)là đồng vị của nhau. B. \({}_{92}^{235}U\,\) và \({}_{92}^{238}U\,\)là hai dạng thù hình của nhau.
C. Hạt nhân \({}_{92}^{235}U\,\) chứa 92 neutron. D. \({}_{92}^{235}U\,\)có 143 electron bên ngoài hạt nhân
Câu 8: Một ion R3+ có phân lớp cuối cùng là 3d5. Cấu hình electron của nguyên tử R là
A. 1s2 2s2 2p6 3s2 3p6 3d5 4s2 4p1. B. 1s2 2s2 2p6 3s2 3p6 3d6 4s2.
C. 1s2 2s2 2p6 3s2 3p2 4s2 3d8. D. 1s2 2s2 2p6 3s2 3p6 3d5 4s3
Câu 9: Cấu hình của nguyên tử sau biểu diễn bằng ô lượng tử. Thông tin nào không đúng khi nói về cấu hình đã cho?
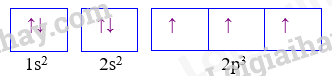
A. Nguyên tử có 7 electron B. Lớp ngoài cùng có 3 electron
C. Nguyên tử có 3 electron độc thân D. Nguyên tử có 2 lớp electron
Câu 10: Anion X- có cấu hình electron của phân lớp ngoài cùng là 2p6.Vị trí của X trong bảng tuần hoàn là
A. Chu kì 3, nhóm IIA B. Chu kì 3,nhóm IVA
C. Chu kì 2,nhóm IVA D. Chu kì 2, nhóm VIIA
II. TỰ LUẬN
Câu 1: Ba nguyên tố X, Y, Z thuộc cùng một chu kì và có tổng số hiệu nguyên tử là 39. Số hiệu của nguyên tử Y bằng trung bình cộng số hiệu của nguyên tử X và Z. Nguyên tử của ba nguyên tố này hầu như không phản ứng với H2O ở điều kiện thường.
a) Hãy xác định vị trí X, Y, Z trong bảng tuần hoàn. Viết cấu hình electron nguyên tử và gọi tên từng nguyên tố.
b) So sánh độ âm điện, bán kính nguyên tử của X, Y, Z.
c) So sánh tính base của các hydroxide của X, Y, Z .
yếu.
Câu 2: Hai nguyên tố X và Y (ZX < ZY) ở hai nhóm A liên tiếp trong bảng tuần hoàn và thuộc cùng chu kì. Tổng số proton trong hạt nhân nguyên tử của X và Y là 33. Xác định tên hai nguyên tố X, Y.
Đáp án
Phần trắc nghiệm
|
1C |
2C |
3D |
4D |
5A |
6B |
7A |
8B |
9B |
10D |
Câu 1: Nguyên tử X có cấu hình e 1s2 2s2 2p5 thì ion tạo ra từ X có khả năng tồn tại độc lập sẽ có cấu hình electron nào sau đây:
A. 1s2 2s2 2p4 B. 1s2 2s2 2p6 3s2 C. 1s2 2s2 2p6 D. 1s2 2s2
Phương pháp giải
Ion X có khả năng nhận thêm 1 electron để đạt cấu hình bền
Lời giải chi tiết
Đáp án C
Câu 2: Nguyên tố Y có Z=27. Vị trí của nguyên tố Y trong bảng hệ thống tuần hoàn là :
A. Chu kì 4, nhóm VIIB B. Chu kì 4, nhóm IIB
C. Chu kì 4, nhóm VIIIB D. Chu kì 4, nhóm IIA
Phương pháp giải
Dựa vào số hiệu nguyên tử của Y để viết cấu hình Y
Lời giải chi tiết
Đáp án C
Câu 3: Cho biết nguyên tố A ở ô thứ 16, chu kì 3, nhóm VIA. Cấu hình electron của A là:
A. 1s22s22p63s23p5 B. 1s22s22p63s23p7 C. 1s22s22p63s23p6 D. 1s22s22p63s23p4
Phương pháp giải
Dựa vào vị trí của nguyên tố A để viết cấu hình A
Lời giải chi tiết
Đáp án D
Câu 4: Phát biểu nào sau đây không đúng? Trong bảng hệ thống tuần hoàn, các nguyên tố:
A. được sắp xếp theo chiều tăng dần điện tích hạt nhân.
B. có cùng số lớp electron trong nguyên tử được xếp thành một hàng.
C. có cùng số electron ở lớp vỏ ngoài cùng được xếp thành một cột.
D. được chia thành 8 nhóm, mỗi nhóm gồm 8 - 18 nguyên tố.
Phương pháp giải
Nhóm gồm 8 nguyên tố
Lời giải chi tiết
Đáp án D
Câu 5: Nguyên tử của nguyên tố Aluminium có 13 electron. Kết luận nào sau đây đúng?

. Nguyên tử Aluminium
A. Lớp electron ngoài cùng của Aluminium có 3e.
B. Lớp electron ngoài cùng của Aluminium có 1e.
C. Lớp L (lớp thứ 2) của Aluminium có 6e.
D. Lớp L (lớp thứ 2) của Aluminium có 3e hay nói cách khác là lớp electron ngoài cùng của Aluminium có 3e.
Lời giải chi tiết
Đáp án A
Câu 6: Cho cấu hình electron nguyên tử của các nguyên tố sau:
X. 1s2 2s2 2p6 3s2; Y. 1s2 2s2 2p6 3s2 3p6 4s1;
Z. 1s2 2s2 2p6 3s2 3p3; T. 1s2 2s2 2p6 3s2 3p6 3d8 4s2.
Dãy cấu hình electron của các nguyên tử nguyên tố kim loại là
A. X, Y, Z. B. X, Y, T. C. Y, Z, T. D. X, Z, T.
Phương pháp giải
Nguyên tử nguyên tố kim loại có 1, 2, 3 hoặc 4 electron lớp ngoài cùng
Lời giải chi tiết
Đáp án B
|
Câu 7: \({}_{92}^{235}U\,\)là nguyên liệu quan trọng của ngành công nghiệp hạt nhân tuy nhiên hàm lượng \({}_{92}^{235}U\)trong tự nhiên rất thấp. Việc làm "giàu" \({}_{92}^{235}U\,\)luôn thu hút sự quan tâm của cộng đồng quốc tế. Phát biểu nào sau đây về \({}_{92}^{235}U\,\)là đúng?
|
Nhà máy hạt nhân |
A. \({}_{92}^{235}U\,\) và \({}_{92}^{238}U\,\)là đồng vị của nhau. B. \({}_{92}^{235}U\,\) và \({}_{92}^{238}U\,\)là hai dạng thù hình của nhau.
C. Hạt nhân \({}_{92}^{235}U\,\) chứa 92 neutron. D. \({}_{92}^{235}U\,\)có 143 electron bên ngoài hạt nhân
Lời giải chi tiết
Đáp án A vì 2 nguyên tử có cùng số proton
Câu 8: Một ion R3+ có phân lớp cuối cùng là 3d5. Cấu hình electron của nguyên tử R là
A. 1s2 2s2 2p6 3s2 3p6 3d5 4s2 4p1. B. 1s2 2s2 2p6 3s2 3p6 3d6 4s2.
C. 1s2 2s2 2p6 3s2 3p2 4s2 3d8. D. 1s2 2s2 2p6 3s2 3p6 3d5 4s3
Phương pháp giải
Ion R3+ đã nhường đi 3 electron để đạt cấu hình bền
Lời giải chi tiết
Đáp án B
Câu 9: Cấu hình của nguyên tử sau biểu diễn bằng ô lượng tử. Thông tin nào không đúng khi nói về cấu hình đã cho?
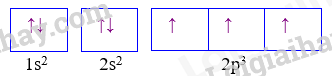
A. Nguyên tử có 7 electron B. Lớp ngoài cùng có 3 electron
C. Nguyên tử có 3 electron độc thân D. Nguyên tử có 2 lớp electron
Phương pháp giải
Dựa vào ô lượng tử ta thấy cấu hình của nguyên tố: 1s22s22p3 có 5 electron lớp ngoài cùng
Lời giải chi tiết
Đáp án B
Câu 10: Anion X- có cấu hình electron của phân lớp ngoài cùng là 2p6.Vị trí của X trong bảng tuần hoàn là
A. Chu kì 3, nhóm IIA B. Chu kì 3,nhóm IVA
C. Chu kì 2,nhóm IVA D. Chu kì 2, nhóm VIIA
Phương pháp giải
Anion X- nhận thêm 1 electron nên cấu hình X: 2p5
Lời giải chi tiết
Đáp án D
II. Tự luận
Câu 1: Ba nguyên tố X, Y, Z thuộc cùng một chu kì và có tổng số hiệu nguyên tử là 39. Số hiệu của nguyên tử Y bằng trung bình cộng số hiệu của nguyên tử X và Z. Nguyên tử của ba nguyên tố này hầu như không phản ứng với H2O ở điều kiện thường.
a) Hãy xác định vị trí X, Y, Z trong bảng tuần hoàn. Viết cấu hình electron nguyên tử và gọi tên từng nguyên tố.
b) So sánh độ âm điện, bán kính nguyên tử của X, Y, Z.
c) So sánh tính base của các hydroxide của X, Y, Z .
Lời giải chi tiết
a) Ta có ZX + ZY +ZZ = 39 (1) với ZX < ZY < ZZ
ZY = \(\frac{{{{\rm{Z}}_{\rm{X}}}{\rm{ + }}{{\rm{Z}}_Z}}}{2}\) (2)
Giải hệ (1) và (2) => ZY =13 =>Y là aluminium (Al)
Cấu hình electron của Y: 1s22s22p63s23p1
Ta có ZX < 13 < ZZ và X,Y,Z thuộc cùng 1 chu kì nên ZX ≥ 11 => ZX =11 hoặc ZX =12
Khi ZX =11 thì X là sodium (Na) không phù hợp vì Na tác dụng với nước ngay ở điều kiện thường.
Khi ZX =12 =>X là magnesium (Mg) và cấu hình electron của Mg: 1s22s22p63s2
=>ZZ = 14 và Z là silicon (Si) và cấu hình electron của Si: 1s22s22p63s23p2
b) Do Mg, Al, Si cùng một chu kì nên
- Độ âm điện: Mg < Al < Si
- Bán kính nguyên tử: Mg > Al > Si
c) Do Mg, Al, Si cùng một chu kì nên
Tính base: Mg(OH)2 > Al(OH)3> H2SiO3
Mg(OH)2là một base yếu; Al(OH)3 là hydroxide lưỡng tính và H2SiO3 là một acid yếu.
Câu 2: Hai nguyên tố X và Y (ZX < ZY) ở hai nhóm A liên tiếp trong bảng tuần hoàn và thuộc cùng chu kì. Tổng số proton trong hạt nhân nguyên tử của X và Y là 33. Xác định tên hai nguyên tố X, Y.
Lời giải chi tiết
- X, Y thuộc cùng chu kì và 2 nhóm A liên tiếp nên ta có: ZY – ZX = 1 (1)
Tổng số proton của X và Y: ZX + ZY = 33 (2)
- Giải hệ (1), (2) ⇒\(\left\{ \begin{array}{l}{Z_X} = 16\, \Rightarrow \,X\,:{\rm{S}}{\rm{.}}\\{Z_Y} = 17\, \Rightarrow \,{\rm{Y : Cl}}{\rm{.}}\end{array} \right.\)
\(\)
Search google: "từ khóa + timdapan.com" Ví dụ: "Đề thi giữa kì 1 Hóa 10 Cánh diều - Đề số 10 timdapan.com"









