Đề thi giữa học kì 1 KHTN 8 - Đề số 5
Câu 1: Công dụng của đèn cồn là A. chứa hóa chất thí nghiệm. B. cố định ống nghiệm. C. đun nóng hóa chất. D. bảo quản hóa chất.
Đề thi
I. Trắc nghiệm
Câu 1: Công dụng của đèn cồn là
A. chứa hóa chất thí nghiệm. B. cố định ống nghiệm.
C. đun nóng hóa chất. D. bảo quản hóa chất.
Câu 2: Trong các quá trình sau, quá trình nào xảy ra biến đổi hóa học?
A. Khi nấu canh cua, gạch cua nổi lên trên. B. Cồn để trong lọ không đậy nắp bị cạn dần.
C. Đun nước, nước sôi bốc hơi. D. Đốt cháy than để nấu nướng.
Câu 3: Cho phản ứng: iron (II) hydroxide + oxygen + nước → iron (III) hydroxide. Số chất phản
ứng trong phản ứng trên là
A. 3. B. 2. C. 1. D. 4.
Câu 4: Phản ứng thu nhiệt là phản ứng trong đó
A. hỗn hợp phản ứng nhận nhiệt từ môi trường.
B. các chất sản phẩm nhận nhiệt từ các chất phản ứng.
C. các chất phản ứng truyền nhiệt cho môi trường.
D. các chất sản phẩm truyền nhiệt cho môi trường.
Câu 5: Tìm nguyên tố X biết X có tỉ khối so với O2 là 2
A. S B. Cu C. Fe D. F
Câu 6: Nung 100g đá vôi ở 1000oC thu được calcium dioxide và 20g khí carbon dioxide. Khối lượng calcium dioxide thu được
A. 120g
B. 20g
C. 80g
D. 100g
Câu 7: Khối lượng H2O2 có trong 30 g dung dịch nồng độ 3%
A. 10 g.
B. 3 g.
C. 0,9 g.
D. 0,1 g.
Câu 8: Đốt cháy than đá (thành phần chính của carbon) sinh ra khí carbon dioxide theo phương trình hóa học sau: C + O2 \( \to \) CO2. Biết khối lượng than đá đem đốt là 30 gam, thể tích khí CO2 đo được (ở dktc) là 49,58 lít. Thành phần phần trăm về khối lượng của carbon trong than đá là
A. 40,0%.
B. 66,9%.
C. 80,0%.
D. 6,7%.
Câu 9: Để điều chế CO2 trong phòng thí nghiệm, người ta cho đá vôi (rắn) phản ứng với dung dịch hydrochloric acid. Phản ứng xảy ra như sau:
CaCO3 + 2HCl → CaCl2 + H2O + CO2. Biện pháp nào sau đây không làm phản ứng xảy ra nhanh hơn?
A. Đập nhỏ đá vôi. B. Tăng nhiệt độ phản ứng.
C. Thêm CaCl2 vào dung dịch. D. Dùng HCl nồng độ cao hơn.
Câu 10: Nhúng mẫu giấy quỳ tím vào dung dịch X thấy màu của giấy quỳ không thay đổi, nhúng mẩu giấy quỳ tím vào dung dịch Y thấy giấy quỳ chuyển sang màu đỏ. Kết luận nào sau đây về dung dịch X và Y là đúng?
A. Cả X và Y đều là dung dịch acid
B. X là dung dịch acid, Y không phải là dung dịch acid.
C. X không phải là dung dịch acid, Y là dung dịch acid.
D. Cả X và Y đều không phải là dung dich acid.
Câu 11: Có thể dùng chất nào sau đây để khử độ chua của đất?
A. Vôi tôi (Ca(OH)2. B. Hydrochloric acid.
C. Muối ăn. D. Cát.
Câu 12: Cho sơ đồ phản ứng sau:
Ca(OH)2 + ? → CaCO3 + H2O. Biết ở vị trí dấu hỏi (?) là một oxide, đó là chất nào sau đây?
A. H2CO3. B. CO2. C. SO2. D. CO.
Câu 13: Các muối nào sau đây đều tan tốt trong nước?
A. Na2SO4, BaSO4, BaCl2.
B. CuSO4, FeCl3, Pb(NO3)2.
C. MgSO4, ZnSO4, PbSO4.
D. K2CO3, CaCO3, CaCl2.
Câu 14: Dung dịch nào sau đây có pH > 7:
A. NaCl B. HCl C. KOH D. Ba(NO3)2
Câu 15: Loại phân bón nào sau đây có trong tro bếp?
A. Phân đạm. B. Phân kali.
C. Super lân. D. Phân lân nung chảy.
II. Tự luận
Câu 1: Hoàn thành sơ đồ phản ứng sau:
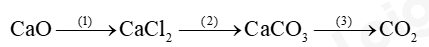
Câu 2: 11.27 Cho dung dịch chứa 32,5 g muối chloride của một kim loại M tác dụng với 300 mL dung dịch NaOH vừa đủ, thu được 21,4 g kết tủa.
a) Xác định kim loại M và công thức muối chloride.
b) Tính nồng độ của dung dịch NaOH đã dùng.
Đáp án
Phần trắc nghiệm
|
1C |
2D |
3A |
4A |
5A |
6C |
7C |
8C |
|
9C |
10C |
11A |
12B |
13B |
14C |
15B |
|
Câu 1: Công dụng của đèn cồn là
A. chứa hóa chất thí nghiệm. B. cố định ống nghiệm.
C. đun nóng hóa chất. D. bảo quản hóa chất.
Phương pháp giải
Công dụng của đèn công là đun nóng hóa chất
Lời giải chi tiết
Đáp án C
Câu 2: Trong các quá trình sau, quá trình nào xảy ra biến đổi hóa học?
A. Khi nấu canh cua, gạch cua nổi lên trên. B. Cồn để trong lọ không đậy nắp bị cạn dần.
C. Đun nước, nước sôi bốc hơi. D. Đốt cháy than để nấu nướng.
Phương pháp giải
Quá trình biến đổi hóa học là quá trình có sự thay đổi chất
Lời giải chi tiết
Đáp án D
Câu 3: Cho phản ứng: iron (II) hydroxide + oxygen + nước → iron (III) hydroxide. Số chất phản
ứng trong phản ứng trên là
A. 3. B. 2. C. 1. D. 4.
Phương pháp giải
Chất phản ứng là chất ban đầu của phản ứng
Lời giải chi tiết
Đáp án A
Câu 4: Phản ứng thu nhiệt là phản ứng trong đó
A. hỗn hợp phản ứng nhận nhiệt từ môi trường.
B. các chất sản phẩm nhận nhiệt từ các chất phản ứng.
C. các chất phản ứng truyền nhiệt cho môi trường.
D. các chất sản phẩm truyền nhiệt cho môi trường.
Phương pháp giải
Phản ứng thu nhiệt là phản ứng thu vào năng lượng dưới dạng nhiệt
Lời giải chi tiết
Đáp án A
Câu 5: Tìm nguyên tố X biết X có tỉ khối so với O2 là 2
A. S B. Cu C. Fe D. F
Phương pháp giải
Dựa vào tỉ khối của X so với O2 để tim M X
Lời giải chi tiết
M X = 2 . 32 = 64
Đáp án A
Câu 6: Nung 100g đá vôi ở 1000oC thu được calcium dioxide và 20g khí carbon dioxide. Khối lượng calcium dioxide thu được
A. 120g
B. 20g
C. 80g
D. 100g
Phương pháp giải
Dựa vào định luật bảo toàn khối lượng
Lời giải chi tiết
m đá vôi = m calcium dioxide + m carbon dioxide
=> m calcium dioxide = 100 – 20 = 80g
Đáp án C
Câu 7: Khối lượng H2O2 có trong 30 g dung dịch nồng độ 3%
A. 10 g.
B. 3 g.
C. 0,9 g.
D. 0,1 g.
Phương pháp giải
Dựa vào công thức tính C% = m chất tan : m dung dịch để tính m chất tan
Lời giải chi tiết
m H2O2 = 30 . 3% = 0,9g
Đáp án C
Câu 8: Đốt cháy than đá (thành phần chính của carbon) sinh ra khí carbon dioxide theo phương trình hóa học sau: C + O2 \( \to \) CO2. Biết khối lượng than đá đem đốt là 30 gam, thể tích khí CO2 đo được (ở dktc) là 49,58 lít. Thành phần phần trăm về khối lượng của carbon trong than đá là
A. 40,0%.
B. 66,9%.
C. 80,0%.
D. 6,7%.
Phương pháp giải
Tính số mol của khí CO2 dựa vào phương trình để tính khối lượng carbon
Lời giải chi tiết
n CO2 = 49,58 : 24,79 = 2 mol
n CO2 = n C = 2 mol => m C = 2.12 = 24g => %m C = (24:30) .100% = 80%
Đáp án C
Câu 9: Để điều chế CO2 trong phòng thí nghiệm, người ta cho đá vôi (rắn) phản ứng với dung dịch hydrochloric acid. Phản ứng xảy ra như sau:
CaCO3 + 2HCl → CaCl2 + H2O + CO2. Biện pháp nào sau đây không làm phản ứng xảy ra nhanh hơn?
A. Đập nhỏ đá vôi. B. Tăng nhiệt độ phản ứng.
C. Thêm CaCl2 vào dung dịch. D. Dùng HCl nồng độ cao hơn.
Phương pháp giải
Dựa vào yếu tố làm ảnh hưởng đến tốc độ phản ứng
Lời giải chi tiết
Đáp án C
Câu 10: Nhúng mẫu giấy quỳ tím vào dung dịch X thấy màu của giấy quỳ không thay đổi, nhúng mẩu giấy quỳ tím vào dung dịch Y thấy giấy quỳ chuyển sang màu đỏ. Kết luận nào sau đây về dung dịch X và Y là đúng?
A. Cả X và Y đều là dung dịch acid
B. X là dung dịch acid, Y không phải là dung dịch acid.
C. X không phải là dung dịch acid, Y là dung dịch acid.
D. Cả X và Y đều không phải là dung dich acid.
Phương pháp giải
Dung dịch X không làm đổi màu quỳ tím => X không phải acid và base
Dung dịch Y làm quỳ tím chuyển sang màu đỏ => Y là dung dịch acid
Lời giải chi tiết
Đáp án C
Câu 11: Có thể dùng chất nào sau đây để khử độ chua của đất?
A. Vôi tôi (Ca(OH)2. B. Hydrochloric acid.
C. Muối ăn. D. Cát.
Phương pháp giải
Độ chua của đất bị gây ra do dư thừa acid
Lời giải chi tiết
Để trung hòa lượng acid dư thừa sử dụng vôi tôi.
Đáp án A
Câu 12: Cho sơ đồ phản ứng sau:
Ca(OH)2 + ? → CaCO3 + H2O. Biết ở vị trí dấu hỏi (?) là một oxide, đó là chất nào sau đây?
A. H2CO3. B. CO2. C. SO2. D. CO.
Phương pháp giải
Dựa vào gốc acid trong muối để xác định chất
Lời giải chi tiết
Đáp án B
Câu 13: Các muối nào sau đây đều tan tốt trong nước?
A. Na2SO4, BaSO4, BaCl2.
B. CuSO4, FeCl3, Pb(NO3)2.
C. MgSO4, ZnSO4, PbSO4.
D. K2CO3, CaCO3, CaCl2.
Phương pháp giải
Dựa vào tính tan của muối trong nước
Lời giải chi tiết
Đáp án B
Câu 14: Dung dịch nào sau đây có pH > 7:
A. NaCl B. HCl C. KOH D. Ba(NO3)2
Phương pháp giải
Dung dịch base có pH > 7
Lời giải chi tiết
Đáp án C
Câu 15: Loại phân bón nào sau đây có trong tro bếp?
A. Phân đạm. B. Phân kali.
C. Super lân. D. Phân lân nung chảy.
Lời giải chi tiết
Đáp án B
II. Tự luận
Câu 1: Hoàn thành sơ đồ phản ứng sau:
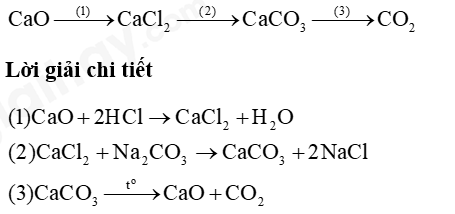
Câu 2: 11.27 Cho dung dịch chứa 32,5 g muối chloride của một kim loại M tác dụng với 300 mL dung dịch NaOH vừa đủ, thu được 21,4 g kết tủa.
a) Xác định kim loại M và công thức muối chloride.
b) Tính nồng độ của dung dịch NaOH đã dùng.
Phương pháp giải
Dựa vào khái niệm tính chất vật lí, tính chất hóa học của muối
Lời giải chi tiết:
a) M hoá trị n, muối có công thức MCln; số mol muối là a mol.
MCln + nNaOH → M(OH)n + nNaCl
a na a na mol
Ta có:
Khối lượng muối là 32,5 gam nên: a.(M + 35,5n) = 32,5 (1)
Khối lượng kết tủa là 21,4 gam nên: a.(M + 17n) = 21,4 (2)
Từ (1) và (2) ta có: \(\frac{M}{m} = \frac{{56}}{3}\)=563
Vậy n = 3; M = 56 thoả mãn.
Kim loại M là Fe, muối là FeCl3.
b) Số mol NaOH = n.a = 3.0,2 = 0,6 mol
Nồng độ dung dịch NaOH đã dùng: 0,6 : 0,3 = 2(M).
Search google: "từ khóa + timdapan.com" Ví dụ: "Đề thi giữa học kì 1 KHTN 8 - Đề số 5 timdapan.com"