Đề số 2 - Đề kiểm tra học kì 2 - Hóa học 12
Đáp án và lời giải chi tiết Đề số 2 - Đề kiểm tra học kì 2 (Đề thi học kì 2) - Hóa học 12
Đề bài
I. PHẦN TRẮC NGHIỆM (3 điểm)
Câu 1. Hóa chất nào sau đây có thể dùng đồng thời làm mềm nước cứng tạm thời và nước cứng vĩnh cửu?
\(\begin{array}{l}A.\,Ca{(OH)_2}\\B.\,N{a_2}C{O_3}\\C.\,C{a_3}{(P{O_4})_2}\\D.\,HCl\end{array}\)
Câu 2. Người ta điện phân nóng chảy muối halogenua của một kim loại thì thu được 62,79 gam kim loại ở catot và 18,032 lít khí bay ra ở anot (đktc). Kim loại kiềm là
A. Li.
B. Na.
C. K.
D. Cs.
Câu 3. Khi điện phân dung dịch chứa các ion: \(A{g^ + },C{u^{2 + }},F{e^{3 + }}.\) Thứ tự các ion kim loại bị khử ở catot là
\(\begin{array}{l}A.\,A{g^ + } > C{u^{2 + }} > F{e^{3 + }}.\\B.\,F{e^{3 + }} > A{g^ + } > C{u^{2 + }} > F{e^{2 + }}.\\C.\,A{g^ + } > F{e^{3 + }} > C{u^{2 + }}.\\D.\,A{g^ + } > F{e^{3 + }} > C{u^{2 + }} > F{e^{2 + }}.\end{array}\)
Câu 4. Bột Al hòa tan được dung dịch nào sau đây?
\(\begin{array}{l}A.\,{H_2}S{O_4}.\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,B.\,N{a_2}C{O_3}.\\C.\,N{H_4}Cl.\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,D.\,N{H_3}.\end{array}\)
Câu 5. Thông tin nào sau đây không đúng?
A. Muối Cr(III) trong môi trường \({H^ + }\) dễ bị khử thành muối Cr(II).
B. Muối Cr(III) trong môi trường \(O{H^ - }\) dễ bị oxi hóa thành muối Cr(VI).
C. Hợp chất Cr(VI) là những chất oxi hóa mạnh.
D. Hợp chất \(Cr{O_3}\) tan trong nước tạo thành dung dịch axit cromic.
Câu 6. Khi hòa tan oxit màu đỏ gạch của một kim loại hóa trị I trong \(HN{O_3},\) thấy có khí không màu hóa nâu ngoài không khí. Vậy kim loại trong oxit có thể là
A. K
B. Cu.
C. Na.
D. Ag.
II. PHẦN TỰ LUẬN (7 điểm)
Câu 1. (2 điểm)
1. Kim loại X rất cứng, tan trong HCl dư đun nóng thu được dung dịch Y. X phản ứng với \(C{l_2}\) rồi hòa tan vào nước được dung dịch z. Thêm tiếp NaOH dư vào Z thấy có kết tủa sau đó kết tủa tan hoàn toàn. Tìm kim loại X và viết các phương trình phản ứng xảy ra.
2. Một lá kim loại Pt bị bám một lớp đồng trên bề mặt. Có thể làm sạch lá Pt bằng cách dùng dung dịch nào trong số các dung dịch sau: \((I)AgN{O_3}\) dư, \((II)HN{O_3}\) loãng dư?
Câu 2. (2 điểm)
1. Giải thích các hiện tượng sau:
a) Các kim loại kiềm phải đảm bảo bằng cách ngâm trong dầu hỏa.
b) Kim loại nhôm nguyên chất tác dụng được với nước nhưng không tan trong nước.
2. Viết các phương trình phản ứng theo sơ đồ:
\(Fe \to FeO \to Fe{(N{O_3})_3} \to Fe{(OH)_3}\)\(\, \to F{e_2}{O_3}\)
Câu 3. (3 điểm)
Chia 20 gam hỗn hợp X gồm Al, Fe, Cu thành hai phần bằng nhau. Phần 1 tác dụng hết với dung dịch HCl thu được 5,6 lít khí (đktc). Phần 2 cho vào dung dịch NaOH dư thu được 3,36 lít khí (đktc).
1. Tính % khối lượng mỗi kim loại có trong hỗn hợp ban đầu.
2. Cho hỗn hợp trên tác dụng với \(HN{O_3}\) đặc, nguội dư được chất khí X màu nâu (sản phẩm khử duy nhất). Tính thể tích khí X (đktc).
Lời giải chi tiết
I. PHẦN TRẮC NGHIỆM (3 điểm)
Câu 1. Chọn B.
\(CO_3^{2 - } + C{a^{2 + }};\)
\(M{g^{2 + }} \to CaC{O_3};MgC{O_3}\)
Câu 2. Chọn C.
\(\begin{array}{l}2MX \to 2M + {X_2}\\1,61 \leftarrow 0,805mol\\ \to M = \dfrac{{62,79}}{{1,61}} = 39(g/mol).\end{array}\)
Câu 3. Chọn D.
+ Ion có tính oxi hóa mạnh hơn (đứng sau trong dãy điện hóa) bị khử trước.
+ \(F{e^{3 + }}\) bị khử thành \(F{e^{2 + }},\) không thể trực tiếp thành Fe.
Câu 4. Chọn A.
\(3{H^ + } + Al \to A{l^{3 + }} + \dfrac{3}{2}{H_2}\)
B, D sai vì dung dịch có tính bazơ yếu không hòa tan được Al.
C sai vì dung dịch có tính axit yếu cũng không hòa tan được A.
Câu 5. Chọn A.
Muối Cr(II) trong môi trường \({H^ + }\) dễ bị oxi hóa thành muối Cr(III).
Câu 6. Chọn B.
\(3C{u_2}O + HN{O_3} \to Cu{(N{O_3})_2} + NO + {H_2}O\)
II. PHẦN TỰ LUẬN (7 điểm)
Câu 1
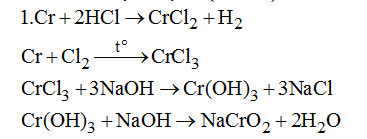
2. Không dùng \(AgN{O_3}\) vì Ag sinh ra bám vào Pt
\(Cu + 2AgN{O_3} \to Cu{(N{O_3})_2} + 2Ag\)
Có thể dùng \(HN{O_3}\) vì \(HN{O_3}\) không hòa tan Pt.
\(3Cu + 8HN{O_3} \to 3Cu{(N{O_3})_2} + 2NO + 4{H_2}O\)
Câu 2. (2 điểm)
1. a) Vì kim loại kiềm hoạt động hóa học mạnh dễ phản ứng với các chất có mặt trong không khí:
\(\begin{array}{l}Na + {H_2}O \to NaOH + {H_2}\\Na + {O_2} \to N{a_2}O + {H_2}O\end{array}\)
b) Nhôm tác dụng với nước: \(Al + 3{H_2}O \to Al{(OH)_3} + \dfrac{3}{2}{H_2}\)
\(Al{(OH)_3}\) là kết tủa keo che phủ phần Al bên trong nên không cho Al tiếp tục phản ứng với nước.
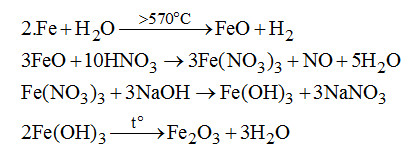
Câu 3. (3 điểm).
\(\begin{array}{l}1.{n_{{H_2}(TN1)}} = 0,25mol;\\{n_{{H_2}(TN2)}} = 0,15mol\\Al + 3HCl \to AlC{l_3} + \dfrac{3}{2}{H_2}\\Fe + 2HCl \to FeC{l_2} + {H_2}\\Al + NaOH + {H_2}O \to NaAl{O_2} + \dfrac{3}{2}{H_2}\end{array}\)
Xét mỗi phần (10 gam).
Phần 2: \({n_{Al}} = \dfrac{2}{3}{n_{{H_2}}} = 0,1mol\)
Phần 1: \({n_{{H_2}}} = \dfrac{3}{2}{n_{Al}} + {n_{Fe}} = 0,25mol\)
\(\begin{array}{l} \to {n_{Al}} = {n_{Fe}} = 0,1mol \\ \to {m_{Al}} = 2,7gam\\ \to \% {m_{Al}} = 27\% \\{m_{Fe}} = 5,6gam \to \% {m_{Fe}} = 56\% \\{m_{Cu}} = 10 - {m_{Al}} - {m_{Fe}} = 1,7gam\\ \to \% {m_{Cu}} = 17\% .\\2.Cu + 4HN{O_3} \to Cu{(N{O_3})_2} + 2N{O_2} + 2{H_2}O\\{n_{N{O_2}}} = 2{n_{Cu}} = \dfrac{{17}}{{32}}(mol)\\ \to {V_{N{O_2}}} = 11,9(lit).\end{array}\)
Search google: "từ khóa + timdapan.com" Ví dụ: "Đề số 2 - Đề kiểm tra học kì 2 - Hóa học 12 timdapan.com"