Đề số 1 - Đề kiểm tra học kì 2 - Hóa học 12
Đáp án và lời giải chi tiết Đề số 1 - Đề kiểm tra học kì 2 (Đề thi học kì 2) - Hóa học 12
Đề bài
I. PHẦN TRẮC NGHIỆM (3 điểm)
Câu 1. Cho dung dịch \(Ba{(OH)_2}\) dư vào 100 ml dung dịch \(NaHC{O_3}\,1M;\,N{a_2}C{O_3}\,0,5M\) thì thu được số gam kết tủa là
A. 19,7 gam.
B. 24,625 gam.
C. 29,55 gam.
D. 34,475 gam.
Câu 2. Dung dịch \(Ba{(OH)_2}\) có thể phản ứng được với tất cả các chất của dãy nào sau đây?
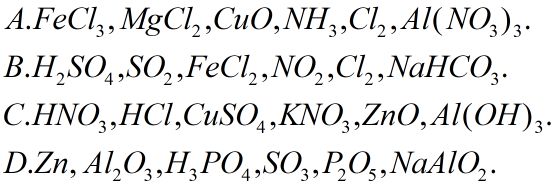
Câu 3. Dùng phương pháp nào sau đây chắc chắn phân biệt được nước cứng tạm thời và nước cứng vĩnh cửu?
A. Cho vào một ít nước vôi trong.
B. Cho vào một ít xôđa \((N{a_2}C{O_3}).\)
C. Đun nóng.
D. Cho vào một ít natri photphat.
Câu 4. Thí nghiệm nào sau đây thu được \(Al{(OH)_3}\) nhiều nhất? (lượng chất chứa nhôm lấy như nhau).
A. Cho bột nhôm tác dụng với nước.
B. Điện phân dung dịch muối nhôm clorua.
C. Cho dung dịch muối nhôm tác dụng với dung dịch kiềm dư.
D. Thổi khí HCl dư vào dung dịch natri aluminat.
Câu 5. Cho các chất: \(AlC{l_3},\,NaHC{O_3},AlOH{)_3},\)\(N{a_2}C{O_3},Al.\) Số chất trong dãy đều tác dụng được với axit HCl, dung dịch NaOH là
A. 4.
B. 5.
C. 3.
D. 2.
Câu 6. Phương trình ion rút gọn: \(2C{l^ - } + 2{H_2}O \to 2O{H^ - } + {H_2} + C{l_2}\) xảy ra khi nào?
A. Cho NaCl vào nước.
B. Điện phân dung dịch NaCl có màng ngăn xốp.
C. Đun sôi dung dịch NaCl.
D. Điện phân nóng chảy NaCl.
II. PHẦN TỰ LUẬN (7 điểm)
Câu 1. (2 điểm).
Cho sơ đồ chuyển hóa (các phản ứng xảy ra hoàn toàn, mỗi chuyển hóa đã có \( \ge 1\) phản ứng xảy ra)
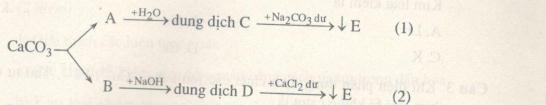
So sánh khối lượng kết tủa của E trong hai trường hợp (1) và (2). Viết các phương trình phản ứng minh họa.
Câu 2. (2 điểm)
a) Từ \(NaCl,CaC{O_3},{H_2}O.\) Viết các phương trình phản ứng điều chế: \(N{a_2}C{O_3},CaC{l_2}.\)
b) Nêu hiện tượng xảy ra và viết các phương trình phản ứng minh họa khi cho mẩu nhỏ Na vào dung dịch \(CuS{O_4}.\)
Câu 3. (3 điểm)
Cho 7,7 gam hỗn hợp bột Na và Al vào 500 ml dung dịch NaOH 0,5M, sau khi phản ứng kết thúc thu được dung dịch A và 7,84 lít khí hiđro (đktc).
1) Tính khối lượng mỗi kim lọa trong hỗn hợp ban đầu.
2) Tính thể tích dung dịch HCl 0,5M cần thêm vào dung dịch A để:
a) Thu được lượng kết tủa lớn nhất
b) Thu được 7,8 gam kết tủa sau khi kết tủa đạt cực đại.
Lời giải chi tiết
I. PHẦN TRẮC NGHIỆM (3 điểm)
Câu 1. Chọn C.
\(\begin{array}{l}{n_{BaC{O_3}}} = {n_{N{a_2}C{O_3}}} + {n_{NaHC{O_3}}} = 0,15mol\\ \Rightarrow {m_{BaC{O_3}}} = 0,15.197 = 29,55gam.\end{array}\)
Câu 2. Chọn B.
Câu 3. Chọn C.
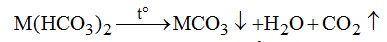
Nước cứng tạm thời sẽ cho kết tủa: \({M^{2 + }} + CO_3^{2 - } \to MC{O_3} \downarrow ;\)\(3{M^{2 + }} + 2PO_4^{3 - } \to {M_3}{(P{O_4})_2} \downarrow \)
A sai: Nước cứng tạm thời sẽ cho kết tủa.
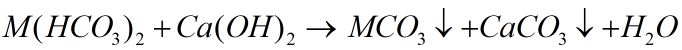
Nước cứng vĩnh cửu cũng có thể cho kết tủa: \(M{g^{2 + }} + 2O{H^ - } \to Mg{(OH)_2} \downarrow \)
Câu 4. Chọn B.
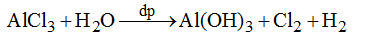
A sai: Thủy phân một phần nhỏ: \(A{l^{3 + }} + 3{H_2}O \to Al{(OH)_3} \downarrow + 3O{H^ - }\)
C, D sai: \(Al{(OH)_3}\) tan trong kiềm dư hoặc HCl dư.
Câu 5. Chọn C.
Câu 6. Chọn B.
II. PHẦN TỰ LUẬN (7 điểm)
Câu 1. (2 điểm)
\(\begin{array}{l}CaC{O_3} \to CaO + C{O_2}\\CaO + {H_2}O \to Ca{(OH)_2}\\Ca{(OH)_2} + N{a_2}C{O_3} \to CaC{O_3} + {H_2}O\end{array}\)
\( \Rightarrow \) trong chuỗi (1), \({n_E} = {n_{CaC{O_3}}}\) ban đầu
\(C{O_2} + NaOH \to N{a_2}C{O_3} + {H_2}O\)
Có thể có: \(C{O_2} + NaOH \to NaHC{O_3}\)
\(N{a_2}C{O_3} + CaC{l_2} \to CaC{O_3} + 2NaCl\)
\(NaHC{O_3} + CaC{l_2}\) không phản ứng.
\( \Rightarrow \) trong chuỗi (2), \({n_E} \le {n_{CaC{O_3}}}\) ban đầu \( \Rightarrow {(E)_2} \le {(E)_1}.\)
Câu 2. (2 điểm).
\(\begin{array}{l}a)2NaCl + 2{H_2}O \to 2NaOH + C{l_2} + {H_2}\\CaC{O_3} \to CaO + C{O_2}\\C{O_2} + 2NaOH \to N{a_2}C{O_3} + {H_2}O\\{H_2} + C{l_2} \to 2HCl\\CaO + 2HCl \to CaC{l_2} + {H_2}O\end{array}\)
b) Miếng natri tan dần, nổi trên mặt dung dịch. Có khí bay lên quanh miếng natri, xuất hiện kết tủa màu xanh lam.
\(\begin{array}{l}2Na + 2{H_2}O \to 2NaOH + {H_2}\\2NaOH + CuS{O_4} \to N{a_2}S{O_4} + Cu{(OH)_2}\end{array}\)
Câu 3. (3 điểm).
\(\begin{array}{l}1.{n_{NaOH}} = 0,25mol;{n_{{H_2}}} = 0,35mol\\2Na + 2{H_2}O \to 2NaOH + {H_2}\\NaOH + {H_2}O + Al \to NaAl{O_2} + \dfrac{3}{2}{H_2}\end{array}\)
Gọi số mol Na và Al lần lượt là x mol và y mol
\(\begin{array}{l} \Rightarrow {m_{hh}} = 23x + 27y = 7,7;\\{n_{{H_2}}} = \dfrac{{x + 3y}}{2} = 0,35\\ \Rightarrow x = 0,1;y = 0,2\\ \Rightarrow {m_{Na}} = 2,3gam;{m_{Al}} = 5,4gam.\end{array}\)
2. Dung dịch A có: NaOH 0,15 mol; \(NaAl{O_2}0,2mol\)
\(\begin{array}{l}HCl + NaOH \to NaCl + {H_2}O\\HCl + NaAl{O_2} + {H_2}O \to NaCl + Al{(OH)_3}\end{array}\)
a) Kết tủa cực đại:
\({n_{HCl}} = {n_{NaOH}} + {n_{NaAl{O_2}}} = 0,35mol \)
\(\Rightarrow {V_{HCl}} = 700ml.\)
b) Kết tủa tan còn 0,78 gam (0,1 mol)
\(Al{(OH)_3} + 3HCl \to AlC{l_3} + 3{H_2}O\)
(0,2 – 0,1) 0,3 mol
\( \Rightarrow {n_{HCl}} = 0,35 + 0,3 = 0,65mol\)
\(\Rightarrow {V_{HCl}} = 1,3\) lít
Search google: "từ khóa + timdapan.com" Ví dụ: "Đề số 1 - Đề kiểm tra học kì 2 - Hóa học 12 timdapan.com"