Bài 18: Tính chất của kim loại và Dãy điện hóa của kim loại
Video bài giảng
1. Tính chất vật lí của Kim loại
- Hầu hết kim loại đều ở trạng thái rắn (trừ Hg) và có các tính chất chung sau: Tính deo, tính dẫn điện, tính dẫn nhiệt và tính ánh kim.
+ Nguyên nhân: Tính chất vật lí chung của kim loại gây nên bởi sự có mặt của các electron tự do trong mạng tinh thể kim loại.
- Ngoài tính chất vật lí chung, kim loại còn có các tính chất riêng sau:
+ Khối lượng riêng: Nhỏ nhất: Li (0,5g/cm3); lớn nhất Os (22,6g/cm3).
+ Nhiệt độ nóng chảy : Thấp nhất : Hg (−390C) ; cao nhất W (34100C).
+ Kim loại mềm nhất là K, Rb, Cs (dùng dao cắt được) và cứng nhất là Cr (có thể cắt được kính).
a. Tính dẻo
- Kim loại có tính dẻo: dễ rèn, dễ dát mỏng và dễ kéo sợi.
+ Nguyên nhân: vì các ion dương trong mạng tinh thể kim loại có thể trượt lên nhau dễ dàng mà không tách rời nhau nhờ những electron tự do chuyển động dính kết chúng với nhau.
+ Kim loại Au có tính dẻo cao.
b. Tính dẫn điện
- Khi đặt một hiệu điện thế vào hai đầu dây kim loại, những electron chuyển động tự do trong kim loại sẽ chuyển động thành dòng có hướng từ cực âm đến cực dương, tạo thành dòng điện.
- Ở nhiệt độ càng cao thì tính dẫn điện của kim loại càng giảm do ở nhiệt độ cao, các ion dương dao động mạnh cản trở dòng electron chuyển động.
- Dãy chất có tính dẫn điện giảm dần là: Ag > Cu > Au > Al > Fe
c. Tính dẫn nhiệt
- Thường các kim loại dẫn điện tốt cũng dẫn nhiệt tốt.
d. Tính ánh kim
- Các electron tự do trong tinh thể kim loại phản xạ hầu hết những tia sáng nhìn thấy được, do đó kim loại có vẻ sáng lấp lánh gọi là ánh kim.
2. Tính chất hóa học của Kim loại
Tính chất hoá học chung của kim loại là tính khử.
M → Mn+ + ne
a. Tác dụng với phi kim: (Cl2; O2; S;...)
- Ví dụ: Thí nghiệm
\(2Fe +3Cl_{2}\overset{t^{0}}{\rightarrow}2FeCl_{3}\)
Ví dụ: Thí nghiệm:
\(2Al +3O_{2}\overset{t^{0}}{\rightarrow}2Al_{2}O_{3}\)
Ví dụ: Thí nghiệm phản ứng với Lưu huỳnh (S)
\(Fe +S\overset{t^{0}}{\rightarrow}FeS\)
b. Tác dụng với dung dịch Axit
- Với dung dịch HCl, H2SO4 loãng : Nhiều kim loại có thể khử được ion H+ trong dung dịch axit thành H2
Ví dụ: Thí nghiệm Fe + 2HCl → FeCl2 + H2
- Với dung dịch HNO3, H2SO4 đặc:
Ví dụ: Thí nghiệm
\(3Cu + 8HN{O_3} \to 3Cu{(N{O_3})_2}_{loang} + 2NO \uparrow + 4{H_2}O\)
Ví dụ: Thí nghiệm
\(Cu + 2{H_2}S{O_4}_{(dac)} \to CuS{O_4} + S{O_2} \uparrow + {\rm{ }}2{H_2}O\)
c. Tác dụng với nước
- Các kim loại có tính khử mạnh: kim loại nhóm IA và IIA (trừ Be, Mg) khử H2O dễ dàng ở nhiệt độ thường.
- Các kim loại có tính khử trung bình chỉ khử nước ở nhiệt độ cao (Fe, Zn,…).
- Các kim loại còn lại không khử được H2O.
d. Tác dụng với dung dịch muối
- Kim loại mạnh hơn có thể khử được ion của kim loại yếu hơn trong dung dịch muối thành kim loại tự do.
Ví dụ: Thí nghiệm
\(Fe + CuS{O_4} \to FeS{O_4} + Cu \downarrow\)
3. Dãy điện hóa
a. Cặp oxi hóa - khử của kim loại
Dạng oxi hoá và dạng khử của cùng một nguyên tố kim loại tạo nên cặp oxi hoá – khử của kim loại.
Ví dụ: Cặp oxi hoá – khử Ag+/Ag; Cu2+/Cu; Fe2+/Fe
b. Dãy điện hóa của kim loại
- Dự đoán chiều của phản ứng oxi hoá – khử theo quy tắc anpha (\(\alpha\)):
chất oxi hoá mạnh hơn + chất khử mạnh hơn → chất oxi hoá yếu hơn + chất khử yếu hơn.
Ví dụ: Phản ứng giữa hai cặp Fe2+/Fe và Cu2+/Cu xảy ra theo chiều ion Cu2+ oxi hoá Fe tạo ra ion Fe2+ và Cu.

Ta có: Fe + Cu2+ → Fe2+ + Cu
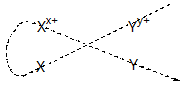
Tổng quát: Giả sử có 2 cặp oxi hoá – khử Xx+/X và Yy+/Y (cặp Xx+/X đứng trước cặp Yy+/Y).
4. Bài tập Tính chất của Kim loại, Dãy điện hóa của kim loại - Cơ bản
Bài 1:
Tiến hành các thí nghiệm sau :
(a) Cho dung dịch AgNO3 vào dung dịch HCl
(b) Cho Al2O3 vào dung dịch HCl loãng dư
(c) Cho Cu vào dung dịch HCl đặc nóng dư
(d) Cho Ba(OH)2 vào dung dịch KHCO3
Sau khi kết thúc các phản ứng, số thí nghiệm thu được chất rắn là :
Hướng dẫn:
(a) AgNO3 + HCl → AgCl + HNO3
(c) Cu không phản ứng với HCl
(d) Ba(OH)2 + 2KHCO3 → K2CO3 + BaCO3 + 2H2O
Bài 2:
Ngâm thanh Cu (dư) vào dung dịch AgNO3 thu được dung dịch X. Sau đó ngâm thanh Fe
(dư) vào dung dịch X thu được dung dịch Y. Biết các phản ứng xảy ra hoàn toàn. Dung dịch Y có chứa chất tan là:
Hướng dẫn:
Cu + Ag+ tạo ra trong dung dịch là Cu2+. Cho Fe (dư) vào dung dịch chứa Cu2+ thì tạo Fe2+.
Bài 3:
Cho 2,24 gam bột sắt vào 200 ml dung dịch CuSO4 0,05M.Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X và m gam chất rắn Y.Gía trị của m là:
Hướng dẫn:
Fe + CuSO4 → FeSO4 + Cu
0,01 0,01 0,01
mchất rắn = mCu + m Fe dư = 0,01.64 + (0,04-0,01).56 = 2,32 (gam)
Bài 4:
Hòa tan hoàn toàn 6,5g Zn bằng dung dịch H2SO4 loãng thu được V lít H2 (đktc). Giá trị của V là:
Hướng dẫn:
Để ý phần electron lúc cho và nhận đều bằng 2 nên ta có:
nH2 = nZn = 6,5 : 65 = 0,1 mol
→ VH2 = 0,1.22,4 = 2,24 lít
5. Bài tập Tính chất của Kim loại, Dãy điện hóa của kim loại - Nâng cao
Bài 1:
Cho 30,8g hỗn hợp X gồm Fe, FeO, FeCO3, Mg, MgO, MgCO3 tác dụng vừa đủ với dung dịch H2SO4 loãng thu được 7,84l khí (đktc) hỗn hợp khí Y gồm CO2, H2 và dung dịch Z chỉ chứa 60,4g hỗn hợp muối sunfat trung hòa. Tỉ khối Y so với He là 6,5. Khối lượng của MgSO4 trong dung dịch Z là:
Hướng dẫn:
nY = 0,35 mol; MY = 26g ⇒ nCO2 = 0,2 mol; nH2 = 0,15 mol
Gọi số mol H2O là x
Bảo toàn H: nH2SO4 = nH2O + nH2 = x + 0,15
Bảo toàn khối lượng: mX + mH2SO4 = m muối + mCO2 + mH2 + mH2O
⇒ 30,8 + 98.(x + 0,15) = 60,4 + 26.0,35 + 18x
⇒ x = 0,3 mol
Trong hỗn hợp muối chỉ có a mol MgSO4 và b mol FeSO4
⇒ mmuối = 120a + 152b = 60,4
nSO4 = a + b = 0,45
⇒ a = 0,25; b = 0,2 mol
⇒ mMgSO4 = 30g
Bài 2:
Hòa tan hoàn toàn m gam Al bằng dung dịch HNO3 loãng, thu được 5,376 lít (đktc)hỗn hợp khí X gồm N2, N2O và dung dịch chứa 8m gam muối.Tỉ khối của X so với H2 bằng 18.Gía trị của m là:
Hướng dẫn:
Nhận thấy :
\(\overline M = \frac{{({M_{{N_2}}} + {M_{{N_2}O}})}}{2} = \frac{{(28 + 44)}}{2} = 36\)
\(\to {n_{{N_2}}} = {n_{{N_2}O}} = \frac{{0,24}}{2} = 0,12(Mol)\)
\({m_{Al{{(N{O_3})}_3}}} = \frac{m}{{27}}.213 = 7,89m < 8m\)
→có NH4NO3
Bảo toàn electron cho phản ứng:
\({3.\frac{m}{{27}} = 10.0,12 + 8.0,12 + 8{n_{N{H_4}N{O_3}}}}\)
\({ \Rightarrow {n_{N{H_4}N{O_3}}} = \frac{m}{{72}} - 0,27(mol)}\)
Khối lượng muối tạo thành : mmuối = mmuối nhôm + m muối amoni
\({8m = 213.\frac{m}{{27}} + 80.\left( {\frac{m}{{27}} - 0,27} \right)}\)
⇒ m = 21,6 gam
1. Tính chất vật lí của Kim loại
- Hầu hết kim loại đều ở trạng thái rắn (trừ Hg) và có các tính chất chung sau: Tính deo, tính dẫn điện, tính dẫn nhiệt và tính ánh kim.
+ Nguyên nhân: Tính chất vật lí chung của kim loại gây nên bởi sự có mặt của các electron tự do trong mạng tinh thể kim loại.
- Ngoài tính chất vật lí chung, kim loại còn có các tính chất riêng sau:
+ Khối lượng riêng: Nhỏ nhất: Li (0,5g/cm3); lớn nhất Os (22,6g/cm3).
+ Nhiệt độ nóng chảy : Thấp nhất : Hg (−390C) ; cao nhất W (34100C).
+ Kim loại mềm nhất là K, Rb, Cs (dùng dao cắt được) và cứng nhất là Cr (có thể cắt được kính).
a. Tính dẻo
- Kim loại có tính dẻo: dễ rèn, dễ dát mỏng và dễ kéo sợi.
+ Nguyên nhân: vì các ion dương trong mạng tinh thể kim loại có thể trượt lên nhau dễ dàng mà không tách rời nhau nhờ những electron tự do chuyển động dính kết chúng với nhau.
+ Kim loại Au có tính dẻo cao.
b. Tính dẫn điện
- Khi đặt một hiệu điện thế vào hai đầu dây kim loại, những electron chuyển động tự do trong kim loại sẽ chuyển động thành dòng có hướng từ cực âm đến cực dương, tạo thành dòng điện.
- Ở nhiệt độ càng cao thì tính dẫn điện của kim loại càng giảm do ở nhiệt độ cao, các ion dương dao động mạnh cản trở dòng electron chuyển động.
- Dãy chất có tính dẫn điện giảm dần là: Ag > Cu > Au > Al > Fe
c. Tính dẫn nhiệt
- Thường các kim loại dẫn điện tốt cũng dẫn nhiệt tốt.
d. Tính ánh kim
- Các electron tự do trong tinh thể kim loại phản xạ hầu hết những tia sáng nhìn thấy được, do đó kim loại có vẻ sáng lấp lánh gọi là ánh kim.
2. Tính chất hóa học của Kim loại
Tính chất hoá học chung của kim loại là tính khử.
M → Mn+ + ne
a. Tác dụng với phi kim: (Cl2; O2; S;...)
- Ví dụ: Thí nghiệm
\(2Fe +3Cl_{2}\overset{t^{0}}{\rightarrow}2FeCl_{3}\)
Ví dụ: Thí nghiệm:
\(2Al +3O_{2}\overset{t^{0}}{\rightarrow}2Al_{2}O_{3}\)
Ví dụ: Thí nghiệm phản ứng với Lưu huỳnh (S)
\(Fe +S\overset{t^{0}}{\rightarrow}FeS\)
b. Tác dụng với dung dịch Axit
- Với dung dịch HCl, H2SO4 loãng : Nhiều kim loại có thể khử được ion H+ trong dung dịch axit thành H2
Ví dụ: Thí nghiệm Fe + 2HCl → FeCl2 + H2
- Với dung dịch HNO3, H2SO4 đặc:
Ví dụ: Thí nghiệm
\(3Cu + 8HN{O_3} \to 3Cu{(N{O_3})_2}_{loang} + 2NO \uparrow + 4{H_2}O\)
Ví dụ: Thí nghiệm
\(Cu + 2{H_2}S{O_4}_{(dac)} \to CuS{O_4} + S{O_2} \uparrow + {\rm{ }}2{H_2}O\)
c. Tác dụng với nước
- Các kim loại có tính khử mạnh: kim loại nhóm IA và IIA (trừ Be, Mg) khử H2O dễ dàng ở nhiệt độ thường.
- Các kim loại có tính khử trung bình chỉ khử nước ở nhiệt độ cao (Fe, Zn,…).
- Các kim loại còn lại không khử được H2O.
d. Tác dụng với dung dịch muối
- Kim loại mạnh hơn có thể khử được ion của kim loại yếu hơn trong dung dịch muối thành kim loại tự do.
Ví dụ: Thí nghiệm
\(Fe + CuS{O_4} \to FeS{O_4} + Cu \downarrow\)
3. Dãy điện hóa
a. Cặp oxi hóa - khử của kim loại
Dạng oxi hoá và dạng khử của cùng một nguyên tố kim loại tạo nên cặp oxi hoá – khử của kim loại.
Ví dụ: Cặp oxi hoá – khử Ag+/Ag; Cu2+/Cu; Fe2+/Fe
b. Dãy điện hóa của kim loại
- Dự đoán chiều của phản ứng oxi hoá – khử theo quy tắc anpha (\(\alpha\)):
chất oxi hoá mạnh hơn + chất khử mạnh hơn → chất oxi hoá yếu hơn + chất khử yếu hơn.
Ví dụ: Phản ứng giữa hai cặp Fe2+/Fe và Cu2+/Cu xảy ra theo chiều ion Cu2+ oxi hoá Fe tạo ra ion Fe2+ và Cu.

Ta có: Fe + Cu2+ → Fe2+ + Cu
Tổng quát: Giả sử có 2 cặp oxi hoá – khử Xx+/X và Yy+/Y (cặp Xx+/X đứng trước cặp Yy+/Y).
4. Bài tập Tính chất của Kim loại, Dãy điện hóa của kim loại - Cơ bản
Bài 1:
Tiến hành các thí nghiệm sau :
(a) Cho dung dịch AgNO3 vào dung dịch HCl
(b) Cho Al2O3 vào dung dịch HCl loãng dư
(c) Cho Cu vào dung dịch HCl đặc nóng dư
(d) Cho Ba(OH)2 vào dung dịch KHCO3
Sau khi kết thúc các phản ứng, số thí nghiệm thu được chất rắn là :
Hướng dẫn:
(a) AgNO3 + HCl → AgCl + HNO3
(c) Cu không phản ứng với HCl
(d) Ba(OH)2 + 2KHCO3 → K2CO3 + BaCO3 + 2H2O
Bài 2:
Ngâm thanh Cu (dư) vào dung dịch AgNO3 thu được dung dịch X. Sau đó ngâm thanh Fe
(dư) vào dung dịch X thu được dung dịch Y. Biết các phản ứng xảy ra hoàn toàn. Dung dịch Y có chứa chất tan là:
Hướng dẫn:
Cu + Ag+ tạo ra trong dung dịch là Cu2+. Cho Fe (dư) vào dung dịch chứa Cu2+ thì tạo Fe2+.
Bài 3:
Cho 2,24 gam bột sắt vào 200 ml dung dịch CuSO4 0,05M.Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X và m gam chất rắn Y.Gía trị của m là:
Hướng dẫn:
Fe + CuSO4 → FeSO4 + Cu
0,01 0,01 0,01
mchất rắn = mCu + m Fe dư = 0,01.64 + (0,04-0,01).56 = 2,32 (gam)
Bài 4:
Hòa tan hoàn toàn 6,5g Zn bằng dung dịch H2SO4 loãng thu được V lít H2 (đktc). Giá trị của V là:
Hướng dẫn:
Để ý phần electron lúc cho và nhận đều bằng 2 nên ta có:
nH2 = nZn = 6,5 : 65 = 0,1 mol
→ VH2 = 0,1.22,4 = 2,24 lít
5. Bài tập Tính chất của Kim loại, Dãy điện hóa của kim loại - Nâng cao
Bài 1:
Cho 30,8g hỗn hợp X gồm Fe, FeO, FeCO3, Mg, MgO, MgCO3 tác dụng vừa đủ với dung dịch H2SO4 loãng thu được 7,84l khí (đktc) hỗn hợp khí Y gồm CO2, H2 và dung dịch Z chỉ chứa 60,4g hỗn hợp muối sunfat trung hòa. Tỉ khối Y so với He là 6,5. Khối lượng của MgSO4 trong dung dịch Z là:
Hướng dẫn:
nY = 0,35 mol; MY = 26g ⇒ nCO2 = 0,2 mol; nH2 = 0,15 mol
Gọi số mol H2O là x
Bảo toàn H: nH2SO4 = nH2O + nH2 = x + 0,15
Bảo toàn khối lượng: mX + mH2SO4 = m muối + mCO2 + mH2 + mH2O
⇒ 30,8 + 98.(x + 0,15) = 60,4 + 26.0,35 + 18x
⇒ x = 0,3 mol
Trong hỗn hợp muối chỉ có a mol MgSO4 và b mol FeSO4
⇒ mmuối = 120a + 152b = 60,4
nSO4 = a + b = 0,45
⇒ a = 0,25; b = 0,2 mol
⇒ mMgSO4 = 30g
Bài 2:
Hòa tan hoàn toàn m gam Al bằng dung dịch HNO3 loãng, thu được 5,376 lít (đktc)hỗn hợp khí X gồm N2, N2O và dung dịch chứa 8m gam muối.Tỉ khối của X so với H2 bằng 18.Gía trị của m là:
Hướng dẫn:
Nhận thấy :
\(\overline M = \frac{{({M_{{N_2}}} + {M_{{N_2}O}})}}{2} = \frac{{(28 + 44)}}{2} = 36\)
\(\to {n_{{N_2}}} = {n_{{N_2}O}} = \frac{{0,24}}{2} = 0,12(Mol)\)
\({m_{Al{{(N{O_3})}_3}}} = \frac{m}{{27}}.213 = 7,89m < 8m\)
→có NH4NO3
Bảo toàn electron cho phản ứng:
\({3.\frac{m}{{27}} = 10.0,12 + 8.0,12 + 8{n_{N{H_4}N{O_3}}}}\)
\({ \Rightarrow {n_{N{H_4}N{O_3}}} = \frac{m}{{72}} - 0,27(mol)}\)
Khối lượng muối tạo thành : mmuối = mmuối nhôm + m muối amoni
\({8m = 213.\frac{m}{{27}} + 80.\left( {\frac{m}{{27}} - 0,27} \right)}\)
⇒ m = 21,6 gam