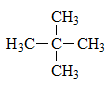Bài 27 Luyện tập Ankan và xicloankan
Bài 1:
Ống nghiệm 1 chứa dd KMnO4, ống nghiệm 2 chứa dd Br2, ống nghiệm 3 chứa dd KOH. Sục khí xiclopropan vào ba ống nghiệm trên thì hiện tượng gì xảy ra.
Hướng dẫn:
Ống 1: màu của dd KMnO4 vẫn giữ nguyên, do xiclopropan không phản ứng với KMnO4.
Ống 2: màu của dd Br2 nhạt dần, do Br2 đã phản ứng với xiclopropan.
Ống 3: hỗn hợp phân thành 2 lớp, do xiclopropan không tan trong dd KOH
Bài 2:
Một ankan X tác dụng vừa đủ với Cl2 (as) theo tỉ lệ 1:1, chỉ thu được một sản phẩm thế duy nhất có khối lượng là 10,65 gam. Để trung hòa hết khí HCl sinh ra cần vừa đủ 100 ml dd NaOH 1M. Xác định công thức cấu tạo của X.
Hướng dẫn:
Phương trình phản ứng:
CnH2n+2 + Cl2 → CnH2n+1Cl + HCl (điều kiện: ánh sáng)
0,1mol 0,1mol
NaOH + HCl → NaCl + H2O
nNaOH = 0,1.1 = 0,1mol
nHCl = 0,1mol
Công thức phân tử củaX là C5H12.
X chỉ tạo một sản phẩm thế monoclorua nên X là:
Bài 3:
Đốt cháy hòa toàn một hiđrocacbon A. Sản phẩm cháy được dẫn qua bình (1) đựng dd H2SO4 đặc dư, sau đó qua bình (2) đựng dd NaOH dư. Sau thí nghiệm khối lượng bình (1) tăng 9 gam, khối lượng bình(2) tăng 17,6 gam. Xác định công thức phân tử của A
Hướng dẫn:
Khối lượng bình 1 tăng chính là khối lượng của nước.
\({m_{{H_2}O}} = 9gam \Rightarrow {n_{H{}_2O}} = \frac{9}{{18}} = 0,5mol\)
Khối lượng bình 2 tăng chính là khối lượng của CO2
\({m_{C{O_2}}} = 17,6gam \Rightarrow {n_{C{O_2}}} = \frac{{17,6}}{{44}} = 0,4mol\)
Do \({n_{C{O_2}}} < {n_{{H_2}O}}\) nên A là ankan.
Ptpư:
\({C_n}{H_{2n + 2}} + \frac{{3n + 1}}{2}{O_2} \to nC{O_2} + (n + 1){H_2}O\)
Ta có:
\(\frac{{{n_{{H_2}O}}}}{{{n_{C{O_2}}}}} = \frac{{n + 1}}{n} = \frac{{0,5}}{{0,4}} \Rightarrow n = 4\)
Vậy A là: C4H10
Bài 4:
Đốt cháy hòa toàn 2,34 gam hỗn hợp 2 ankan là đồng đẳng kế tiếp nhau rồi hấp thụ hết sản phẩm cháy vào dd Ca(OH)2 dư, thu được 16 gam kết tủa. Xác định công thức phân tử của hai ankan trên.
Hướng dẫn:
Gọi công thức chung của 2 ankan là:
\({C_{\overline n }}{H_{2\overline n + 2}}(\overline n > 1)\)
\({C_{\overline n }}{H_{2\overline n + 2}} + \frac{{3\overline n + 1}}{2}{O_2} \to \overline n C{O_2} + (\overline n - 1){H_2}O\)
\(\frac{{0,16}}{{\overline n }}\)
Ca(OH)2 + CO2 → CaCO3 + H2O
\(\begin{array}{*{20}{l}}
\begin{array}{l}
{n_{CaC{O_3}}} = \frac{{16}}{{100}} = 0,16mol\\
\Rightarrow {n_{C{O_2}}} = 0,16mol
\end{array}\\
\begin{array}{l}
\Rightarrow \frac{{0,16}}{{\bar n}}.(14\bar n + 2) = 2,34\\
\Rightarrow \bar n = 3,2
\end{array}
\end{array}\)
Do 2 ankan là đồng đẳng kế tiếp nhau nên hai ankan trên là: C3H8 và C4H10
Bài 1:
Ống nghiệm 1 chứa dd KMnO4, ống nghiệm 2 chứa dd Br2, ống nghiệm 3 chứa dd KOH. Sục khí xiclopropan vào ba ống nghiệm trên thì hiện tượng gì xảy ra.
Hướng dẫn:
Ống 1: màu của dd KMnO4 vẫn giữ nguyên, do xiclopropan không phản ứng với KMnO4.
Ống 2: màu của dd Br2 nhạt dần, do Br2 đã phản ứng với xiclopropan.
Ống 3: hỗn hợp phân thành 2 lớp, do xiclopropan không tan trong dd KOH
Bài 2:
Một ankan X tác dụng vừa đủ với Cl2 (as) theo tỉ lệ 1:1, chỉ thu được một sản phẩm thế duy nhất có khối lượng là 10,65 gam. Để trung hòa hết khí HCl sinh ra cần vừa đủ 100 ml dd NaOH 1M. Xác định công thức cấu tạo của X.
Hướng dẫn:
Phương trình phản ứng:
CnH2n+2 + Cl2 → CnH2n+1Cl + HCl (điều kiện: ánh sáng)
0,1mol 0,1mol
NaOH + HCl → NaCl + H2O
nNaOH = 0,1.1 = 0,1mol
nHCl = 0,1mol
Công thức phân tử củaX là C5H12.
X chỉ tạo một sản phẩm thế monoclorua nên X là:
Bài 3:
Đốt cháy hòa toàn một hiđrocacbon A. Sản phẩm cháy được dẫn qua bình (1) đựng dd H2SO4 đặc dư, sau đó qua bình (2) đựng dd NaOH dư. Sau thí nghiệm khối lượng bình (1) tăng 9 gam, khối lượng bình(2) tăng 17,6 gam. Xác định công thức phân tử của A
Hướng dẫn:
Khối lượng bình 1 tăng chính là khối lượng của nước.
\({m_{{H_2}O}} = 9gam \Rightarrow {n_{H{}_2O}} = \frac{9}{{18}} = 0,5mol\)
Khối lượng bình 2 tăng chính là khối lượng của CO2
\({m_{C{O_2}}} = 17,6gam \Rightarrow {n_{C{O_2}}} = \frac{{17,6}}{{44}} = 0,4mol\)
Do \({n_{C{O_2}}} < {n_{{H_2}O}}\) nên A là ankan.
Ptpư:
\({C_n}{H_{2n + 2}} + \frac{{3n + 1}}{2}{O_2} \to nC{O_2} + (n + 1){H_2}O\)
Ta có:
\(\frac{{{n_{{H_2}O}}}}{{{n_{C{O_2}}}}} = \frac{{n + 1}}{n} = \frac{{0,5}}{{0,4}} \Rightarrow n = 4\)
Vậy A là: C4H10
Bài 4:
Đốt cháy hòa toàn 2,34 gam hỗn hợp 2 ankan là đồng đẳng kế tiếp nhau rồi hấp thụ hết sản phẩm cháy vào dd Ca(OH)2 dư, thu được 16 gam kết tủa. Xác định công thức phân tử của hai ankan trên.
Hướng dẫn:
Gọi công thức chung của 2 ankan là:
\({C_{\overline n }}{H_{2\overline n + 2}}(\overline n > 1)\)
\({C_{\overline n }}{H_{2\overline n + 2}} + \frac{{3\overline n + 1}}{2}{O_2} \to \overline n C{O_2} + (\overline n - 1){H_2}O\)
\(\frac{{0,16}}{{\overline n }}\)
Ca(OH)2 + CO2 → CaCO3 + H2O
\(\begin{array}{*{20}{l}}
\begin{array}{l}
{n_{CaC{O_3}}} = \frac{{16}}{{100}} = 0,16mol\\
\Rightarrow {n_{C{O_2}}} = 0,16mol
\end{array}\\
\begin{array}{l}
\Rightarrow \frac{{0,16}}{{\bar n}}.(14\bar n + 2) = 2,34\\
\Rightarrow \bar n = 3,2
\end{array}
\end{array}\)
Do 2 ankan là đồng đẳng kế tiếp nhau nên hai ankan trên là: C3H8 và C4H10