Bài 3: Sự điện li của nước - pH và Chất chỉ thị axit-bazơ
1. Nước là chất điện li rất yếu
1.1. Sự điện li của nước
- Nước là chất điện rất yếu.
- Phương trình điện li: H2O ⇔ H+ + OH-
1.2. Tích số ion của nước
- Ở 25OC, hằng số KH2O gọi là tích số ion của nước.
KH2O = [H+]. [OH -] = 10-14
→ [H+] = [OH -] = 10-7
- Nước là môi trường trung tính, nên môi trường trung tính là môi trường trong đó [H+] = [OH] = 10-7
1.3. Ý nghĩa tích số ion của nước
*Trong môi trường axit
Ví dụ: Tính [H+] và [OH -] của dung dịch HCl 10-3 M.
HCl → H+ + Cl-
10-3 M → 10-3 M
⇒ [H+] = [HCl] = 10-3 M
⇒ \([O{H^ - }] = \frac{{{{10}^{ - 14}}}}{{[{H^ + }]}} = \frac{{{{10}^{ - 14}}}}{{{{10}^{ - 3}}}} = {10^{ - 11}}M\)
⇒ [H+] > [OH-] hay [H+] >10-7 M.
*Trong môi trường bazơ
Ví dụ: Tính [H+] và [OH-] của dung dịch NaOH 10-5 M
NaOH → Na+ + OH-
10-5 M → 10-5 M
⇒ [OH-] = [NaOH] = 10-5 M
⇒ \([{H^ + }] = \frac{{{{10}^{ - 14}}}}{{[O{H^ - }]}} = \frac{{{{10}^{ - 14}}}}{{{{10}^{ - 5}}}} = {10^{ - 9}}M\)
⇒ [OH-] > [H+]
* Kết luận
Vậy [H+] là đại lượng đánh giá độ axít, độ bazơ của dung dịch.
Mt trung tính: [H+] = 10-7 M
Mt bazơ : [H+] <10-7 M
Mt axít: [H+] > 10-7 M
2. Khái niệm về pH, chất chỉ thị axit bazơ
2.1. Khái niệm pH
Dung dịch được sử dụng nhiều thường có [H+] trong khoảng 10 -1 à 10-14 M. Để tránh ghi giá trị [H+] với số mũ âm, người ta dùng pH.
Công thức: [H+] = 10-pH M hay pH= -lg [H+]
Nếu [H+] = 10-a M thì pH = a
Ví dụ:
[H+] = 10-3 M ⇒ pH=3 môi trường axít
[H+] = 10-11 M ⇒ pH = 11: môi trường bazơ
[H+]= 10-7 M ⇒ pH = 7 :môi trường trung tính.
2.2. Chất chỉ thị Axit - bazơ
- Là chất có màu biến đổi phụ thuộc vào giá trị pH của dung dịch
- Ví dụ: Quỳ tím, phenolphtalein
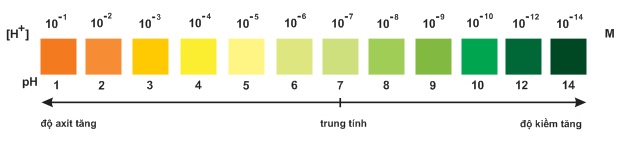
Hình 1: Màu của chất chỉ thị vạn năng
(Thuốc thử MERCK của Đức) ở các giá trị pH khác nhau
Video 1: Chỉ thị đo pH từ bắp cải tím
Bài 1:
Có 5 dung dịch NH3, HCl, NH4Cl, Na2CO3, CH3COOH được đánh ngẫu nhiên là A, B, C, D, E. Giá trị pH và khả năng dẫn điện của dung dịch theo bảng sau:
- Dung dịch A:
+ pH: 5,15
+ Khả năng dẫn điện: Tốt
- Dung dịch B:
+ pH: 10,35
+ Khả năng dẫn điện: Tốt
- Dung dịch C:
+ pH : 4,95
+ Khả năng dẫn điện: Kém
- Dung dịch D:
+ pH : 1,25
+ Khả năng dẫn điện: Tốt
- Dung dịch E:
+ pH : 10,60
+ Khả năng dẫn điện: Kém
Các dung dịch A, B, C, D, E lần lượt là:
Hướng dẫn:
Các chất điện ly mạnh và phân ly ra càng nhiều ion so với số phân tử chất ban đầu thì dẫn điện càng mạnh
Chất dẫn điện tốt: HCl; NH4Cl; Na2CO3
Chất dẫn điện kém là: CH3COOH; NH3
Độ pH tăng dần: HCl; CH3COOH; NH4Cl; NH3; Na2CO3
Bài 2:
Cho các dung dịch có cùng nồng độ mol/l: NaHCO3 (1), Na2CO3 (2), NaCl (3), NaOH (4). pH của các dung dịch tăng theo thứ tự:
Hướng dẫn:
NaOH là bazơ mạnh nên có pH lớn nhất
Muối Na2CO3 có pH > muối NaHCO3 vì HCO3- vẫn còn 1 Hidro có khả năng phân ly thành H+ nhưng vẫn có tính bazo mà không đáng kể
NaCl là muối trung tính nên pH thấp nhất
Vậy ta kết luận pH của các dung dịch tăng theo thứ tự: 3, 1, 2, 4.
Bài 3:
Cho V lít dung dịch Ba(OH)2 0,025M vào 200ml dung dịch X có pH = 1 gồm HNO3 và HCl, thu được dung dịch có pH = 2. Giá trị của V là:
Hướng dẫn:
pH dung dịch sau = 2 < 7 ⇒ H+ dư
⇒ nH+ - nOH- = nH+ (sau)
⇒ 0,02 – 0,05V = 0,01.(V + 0,2)
⇒ V = 0,3 lit
1. Nước là chất điện li rất yếu
1.1. Sự điện li của nước
- Nước là chất điện rất yếu.
- Phương trình điện li: H2O ⇔ H+ + OH-
1.2. Tích số ion của nước
- Ở 25OC, hằng số KH2O gọi là tích số ion của nước.
KH2O = [H+]. [OH -] = 10-14
→ [H+] = [OH -] = 10-7
- Nước là môi trường trung tính, nên môi trường trung tính là môi trường trong đó [H+] = [OH] = 10-7
1.3. Ý nghĩa tích số ion của nước
*Trong môi trường axit
Ví dụ: Tính [H+] và [OH -] của dung dịch HCl 10-3 M.
HCl → H+ + Cl-
10-3 M → 10-3 M
⇒ [H+] = [HCl] = 10-3 M
⇒ \([O{H^ - }] = \frac{{{{10}^{ - 14}}}}{{[{H^ + }]}} = \frac{{{{10}^{ - 14}}}}{{{{10}^{ - 3}}}} = {10^{ - 11}}M\)
⇒ [H+] > [OH-] hay [H+] >10-7 M.
*Trong môi trường bazơ
Ví dụ: Tính [H+] và [OH-] của dung dịch NaOH 10-5 M
NaOH → Na+ + OH-
10-5 M → 10-5 M
⇒ [OH-] = [NaOH] = 10-5 M
⇒ \([{H^ + }] = \frac{{{{10}^{ - 14}}}}{{[O{H^ - }]}} = \frac{{{{10}^{ - 14}}}}{{{{10}^{ - 5}}}} = {10^{ - 9}}M\)
⇒ [OH-] > [H+]
* Kết luận
Vậy [H+] là đại lượng đánh giá độ axít, độ bazơ của dung dịch.
Mt trung tính: [H+] = 10-7 M
Mt bazơ : [H+] <10-7 M
Mt axít: [H+] > 10-7 M
2. Khái niệm về pH, chất chỉ thị axit bazơ
2.1. Khái niệm pH
Dung dịch được sử dụng nhiều thường có [H+] trong khoảng 10 -1 à 10-14 M. Để tránh ghi giá trị [H+] với số mũ âm, người ta dùng pH.
Công thức: [H+] = 10-pH M hay pH= -lg [H+]
Nếu [H+] = 10-a M thì pH = a
Ví dụ:
[H+] = 10-3 M ⇒ pH=3 môi trường axít
[H+] = 10-11 M ⇒ pH = 11: môi trường bazơ
[H+]= 10-7 M ⇒ pH = 7 :môi trường trung tính.
2.2. Chất chỉ thị Axit - bazơ
- Là chất có màu biến đổi phụ thuộc vào giá trị pH của dung dịch
- Ví dụ: Quỳ tím, phenolphtalein

Hình 1: Màu của chất chỉ thị vạn năng
(Thuốc thử MERCK của Đức) ở các giá trị pH khác nhau
Video 1: Chỉ thị đo pH từ bắp cải tím
Bài 1:
Có 5 dung dịch NH3, HCl, NH4Cl, Na2CO3, CH3COOH được đánh ngẫu nhiên là A, B, C, D, E. Giá trị pH và khả năng dẫn điện của dung dịch theo bảng sau:
- Dung dịch A:
+ pH: 5,15
+ Khả năng dẫn điện: Tốt
- Dung dịch B:
+ pH: 10,35
+ Khả năng dẫn điện: Tốt
- Dung dịch C:
+ pH : 4,95
+ Khả năng dẫn điện: Kém
- Dung dịch D:
+ pH : 1,25
+ Khả năng dẫn điện: Tốt
- Dung dịch E:
+ pH : 10,60
+ Khả năng dẫn điện: Kém
Các dung dịch A, B, C, D, E lần lượt là:
Hướng dẫn:
Các chất điện ly mạnh và phân ly ra càng nhiều ion so với số phân tử chất ban đầu thì dẫn điện càng mạnh
Chất dẫn điện tốt: HCl; NH4Cl; Na2CO3
Chất dẫn điện kém là: CH3COOH; NH3
Độ pH tăng dần: HCl; CH3COOH; NH4Cl; NH3; Na2CO3
Bài 2:
Cho các dung dịch có cùng nồng độ mol/l: NaHCO3 (1), Na2CO3 (2), NaCl (3), NaOH (4). pH của các dung dịch tăng theo thứ tự:
Hướng dẫn:
NaOH là bazơ mạnh nên có pH lớn nhất
Muối Na2CO3 có pH > muối NaHCO3 vì HCO3- vẫn còn 1 Hidro có khả năng phân ly thành H+ nhưng vẫn có tính bazo mà không đáng kể
NaCl là muối trung tính nên pH thấp nhất
Vậy ta kết luận pH của các dung dịch tăng theo thứ tự: 3, 1, 2, 4.
Bài 3:
Cho V lít dung dịch Ba(OH)2 0,025M vào 200ml dung dịch X có pH = 1 gồm HNO3 và HCl, thu được dung dịch có pH = 2. Giá trị của V là:
Hướng dẫn:
pH dung dịch sau = 2 < 7 ⇒ H+ dư
⇒ nH+ - nOH- = nH+ (sau)
⇒ 0,02 – 0,05V = 0,01.(V + 0,2)
⇒ V = 0,3 lit