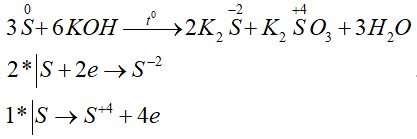Phương pháp giải một số bài tập về Lưu huỳnh
Phương pháp giải một số bài tập về Lưu huỳnh
Dạng 1: Lý thuyết về lưu huỳnh
* Một số ví dụ điển hình
Ví dụ 1: Kết luận gì có thể rút ra được từ 2 phản ứng sau :
H2 + S .\(\xrightarrow{{{t}^{o}}}\). H2S (1)
S + O2 \(\xrightarrow{{{t}^{o}}}\) SO2 (2)
A. S chỉ có tính khử.
B. S chỉ có tính oxi hóa.
C. S vừa có tính khử, vừa có tính oxi hóa.
D. S chỉ tác dụng với các phi kim.
Hướng dẫn giải chi tiết
(1) : Số OXH của S giảm từ 0 => -2
S là chất OXH
(2): Số OXH của S tăng từ 0 => +4
S là chất khử
Đáp án C.
Ví dụ 2: Hơi thủy ngân rất độc, do đó phải thu hồi thủy ngân rơi vãi bằng cách :
A. nhỏ nước brom lên giọt thủy ngân.
B. nhỏ nước ozon lên giọt thủy ngân.
C. rắc bột lưu huỳnh lên giọt thủy ngân.
D. rắc bột photpho lên giọt thủy ngân.
Hướng dẫn giải chi tiết
S tác dụng với Hg ngay ở nhiệt độ thường, nên trong trường hợp này ta cần rắc bột lưu huỳnh lên giọt thủy ngân.
Đáp án C
Ví dụ 3: Lưu huỳnh tác dụng với dung dịch kiềm nóng theo phản ứng sau :
S + KOH → K2S + K2SO3 + H2O
Tỉ lệ số nguyên tử lưu huỳnh bị oxi hóa và số nguyên tử lưu huỳnh bị khử là :
A. 2 : 1. B. 1 : 2.
C. 1 : 3. D. 2 : 3.
Hướng dẫn giải chi tiết:
Đáp án B
Dạng 2: Một số bài tập về tính chất hóa học của S
Ví dụ 1: Nung nóng 3,72 gam hỗn hợp gồm các kim loại Zn và Fe trong bột S dư. Chất rắn thu được sau phản ứng được hòa tan hoàn toàn bằng dung dịch H2SO4 loãng, nhận thấy có 1,344 lít khí thoát ra. Xác định khối lượng mỗi kim loại trong hỗn hợp ban đầu.
* Hướng dẫn giải chi tiết:
Qúa trình phản ứng của hỗn hợp kim loại được tóm tắt như sau:
\(Zn,Fe \to ZnS,FeS \to ZnC{l_2},FeC{l_2}\)
Gọi số mol của Zn, Fe trong hỗn hợp lần lượt là a, b (mol)
* Tổng khối lượng 2 kim loại là 3,72 gam
=> 65a + 56b = 3,72 (I)
n H2S = 1,344 : 22,4 = 0,06 (mol)
Áp dụng định luật bảo toàn electron ta có:
|
Zn → Zn+2 +2e a 2a Fe → Fe+2 + 2e b 2b |
S +2e → S-2 0,12 0,06 |
=> 2a + 2b = 0,12 (II)
Từ (I) và (II) => a = 0,04 ; b = 0,02
m Zn = 0,04 * 65 = 2,6 gam
m Fe = 0,02 * 56 = 2,8 gam
Ví dụ 2: Đốt nóng một hỗn hợp gồm 3,2 gam S vào 7,5 gam bột kẽm trong môi trường kín không có không khí. Tính khối lượng muối thu được sau phản ứng
Hướng dẫn giải chi tiết:
Ta có phương trình:
Zn + S ZnS (1)
n S = 3,2 : 32 = 0,1 mol
n Zn = 7,5 : 65 = 0,11
=> Sau phản ứng Zn phản ứng hết, S còn dư
Số mol ZnS được tính theo số mol Zn.
(1) => n ZnS = n Zn = 0,1 mol
=> m ZnS = 0,1 * 97 = 9,7 gam.
Ví dụ 3: Đốt nóng một hỗn hợp gồm 5,6 gam bột sắt và 1,6 gam bột S trong môi trường không có không khí thu được hỗn hợp chất rắn X. Cho hỗn hợp X phản ứng hoàn toàn với 500 ml dung dịch HCl dư, thu được hỗn hợp khí A và dung dịch B (hiệu suất các phản ứng là 100%). Tính thành phần phần trăm theo thể tích của hỗn hợp khí A.
Hướng dẫn giải chi tiết:
n Fe = 5,6 : 56 = 0,1 mol
n S = 1,6 : 32 = 0,05 mol
Ta có phương trình phản ứng:
Fe + S → FeS (1)
=> Sau phản ứng S phản ứng hết, Fe còn dư.
Chất rắn còn lại sau phản ứng này là FeS, Fe dư
Từ (1) => n FeS = nFe (pu) = n S = 0,05 (mol)
=> n Fe dư = 0,1 – 0,05 = 0,05 mol
Ta có phương trình:
Fe + 2HCl → FeCl2 + H2 (2)
FeS + 2HCl → FeCl2 + H2S (3)
Từ (2) => n H2 = n Fe = 0,05 (mol)
Từ (3) => n H2S = n FeS = 0,05 (mol)
%V H2 = % V H2S = 50%
Search google: "từ khóa + timdapan.com" Ví dụ: "Phương pháp giải một số bài tập về Lưu huỳnh timdapan.com"