Bài 6. Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố trong một chu kì và trong một nhóm trang 34, 35, 36, 37, 38, 39 Hóa 10 Kết nối tri thức
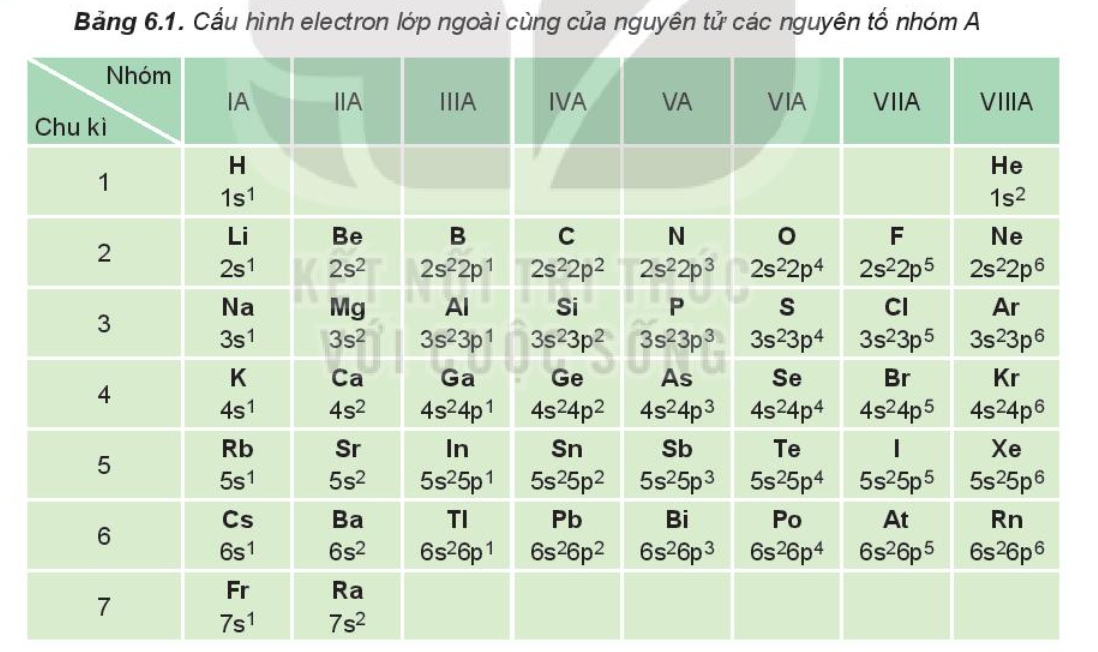
Trong bảng tuần hoàn, một số tính chất của nguyên tử và đơn chất biến đổi 1. Dựa vào Bảng 6.1, cho biết số electron lớp ngoài cùng của nguyên tử các nguyên tố: Li, Al, Ar, Ca, Si, Se, P, Br. 2. Nêu vị trí trong bảng tuần hoàn của các nguyên tố có Z = 8; Z = 17 và Z = 20. Xác định số electron hóa trị của nguyên tử các nguyên tố.
MĐ
|
Trong bảng tuần hoàn, một số tính chất của nguyên tử và đơn chất biến đổi theo xu hướng nào trong một chu kì trong một nhóm A? Vì sao? |
Phương pháp giải:
- Trong một chu kỳ
+ đối với nguyên tử: bán kính giảm dần, số electron hóa trị và độ âm điện tăng dần
+ đối với đơn chất: tính kim loại giảm dần, tính phi kim tăng dần
- Trong một nhóm:
+ đối với nguyên tử: bán kính và số lớp electron tăng dần, độ âm điện giảm dần
+ đối với đơn chất: tính kim loại tăng dần và phi kim giảm dần
Lời giải chi tiết:
- Trong một chu kì, khi đi từ trái sang phải:
+ Bán kính nguyên tử giảm dần, độ âm điện tăng dần.
+ Tính kim loại giảm dần và tính phi kim tăng dần.
+ Số electron hóa trị của nguyên tử các nguyên tố nhóm A tăng lần lượt từ 1 đến 8
- Trong một nhóm A, khi đi từ trên xuống dưới:
+ Bán kính nguyên tử tăng dần, độ âm điện giảm dần
+ Tính kim loại tăng dần và tính phi kim giảm dần.
+ Số lớp electron của nguyên tử các nguyên tố tăng dần
CH
|
Dựa vào Bảng 6.1, cho biết số electron lớp ngoài cùng của nguyên tử các nguyên tố: Li, Al, Ar, Ca, Si, Se, P, Br
|
Phương pháp giải:
Nguyên tử của các nguyên tố cùng một nhóm A có số electron lớp ngoài cùng ( electron hóa trị) bằng nhau. => Số thứ tự nhóm bằng số electron lớp ngoài cùng của nguyên tử.
Lời giải chi tiết:
Trong bảng 6.1, nguyên tố:
+ Li nằm ở nhóm IA => Li có 1 electron lớp ngoài cùng.
+ Al nằm ở nhóm IIIA => Al có 3 electron lớp ngoài cùng.
+ Ar nằm ở nhóm VIIIA => Ar có 8 electron lớp ngoài cùng.
+ Ca nằm ở nhóm IIA => Ca có 2 electron lớp ngoài cùng.
+ Si nằm ở nhóm IVA => Si có 4 electron lớp ngoài cùng.
+ Se nằm ở nhóm VIA => Se có 6 electron lớp ngoài cùng.
+ Br nằm ở nhóm VIIA => Br có 7 electron lớp ngoài cùng.
CH
|
Nêu vị trí trong bảng tuần hoàn của các nguyên tố có Z = 8; Z = 11; Z = 17 và Z = 20. Xác định số electron hóa trị của nguyên tử các nguyên tố đó. |
Phương pháp giải:
Z là số hiệu nguyên tử của các nguyên tố. Số hiệu nguyên tử bằng số thứ tự của nguyên tố trong bảng tuần hoàn hóa học.
Lời giải chi tiết:
Z = 8 => Nguyên tố nằm ở ô số 8, chu kì 2, nhóm VIA => Có 6 electron hóa trị.
Z = 11 => Nguyên tố nằm ở ô số 11, chu kì 3, nhóm IA => Có 1 electron hóa trị.
Z = 17 => Nguyên tố nằm ở ô số 17, chu kì 3, nhóm VIIA => Có 7 electron hóa trị.
Z = 20 => Nguyên tố nằm ở ô số 20, chu kì 4, nhóm IIA => Có 2 electron hóa trị.
CH
| Dựa vào bảng tuần hoàn, hãy so sánh và giải thích sự khác nhau về bán kính nguyên tử của a) lithium (Z = 3) và potassium (Z = 19). b) calcium (Z = 20) và selenium ( Z = 34) |
Phương pháp giải:
- Trong một chu kì, bán kính nguyên tử giảm theo chiều tăng dần của điện tích hạt nhân.
- Trong một nhóm A, bán kính nguyên tử tăng theo chiều tăng dần của điện tích hạt nhân
Lời giải chi tiết:
a) Lithium và potassium nằm cùng một nhóm IA trong bảng tuần hoàn.
=> Bán kính nguyên tử của lithium nhỏ hơn bán kính nguyên tử của potassium.
b) Calcium và selenium nằm cùng một chu kì 4 trong bảng tuần hoàn.
=> Bán kính nguyên tử của calcium lớn hơn bán kính nguyên tử của selenium.
CH
|
Dãy các nguyên tố được sắp xếp theo thứ tự độ âm điện tăng dần là Ca, Mg, P, S. Hãy giải thích sự sắp xếp này dựa trên sự biến đổi độ âm điện theo chu kì và nhóm A. |
Phương pháp giải:
- Độ âm điện tăng từ trái qua phải trong một chu kì.
- Độ âm điện giảm dần từ trên xuống dưới trong một nhóm.
Lời giải chi tiết:
- Ca (Z =20), Mg (Z = 12), P (Z = 15) và S (Z = 16) cùng nằm ở chu kì 2
- Trong một chu kì, khi số electron lớp ngoài cùng tăng, điện tích hạt nhân tăng thì lực hút giữa hạt nhân với các electron lớp ngoài cùng tăng nên độ âm điện tăng.
CH
|
Almelec là hợp kim của aluminium với một lượng nhỏ magnesium và silicon (98,8% aluminium; 0,7% magnesium và 0,5 % silicon). Almelec được sử dụng làm dây điện cao thế do nhẹ, dẫn điện tốt và bền. Dựa vào bảng tuần hoàn các nguyên tố hóa học, hãy: a) Sắp xếp theo thứ tự tăng dần về bán kính nguyên tử các nguyên tố hóa học có trong almelec. b) Cho biết thứ tự giảm dần về độ âm điện của các nguyên tố hóa học có trong almelec. |
Phương pháp giải:
- Trong một chu kì, bán kính nguyên tử giảm theo chiều tăng dần của điện tích hạt nhân.
- Trong một nhóm A, bán kính nguyên tử tăng theo chiều tăng dần của điện tích hạt nhân
- Độ âm điện tăng từ trái qua phải trong một chu kì.
- Độ âm điện giảm dần từ trên xuống dưới trong một nhóm.
Lời giải chi tiết:
a) Mg (Z = 12 ), Al (Z = 13) và Si (Z = 14) cùng nằm ở chu kì 3 => bán kính nguyên tử tăng dần theo thứ tự: Si, Al, Mg.
b) Mg (Z = 12 ), Al (Z = 13) và Si (Z = 14) cùng nằm ở chu kì 3 => độ âm điện của các nguyên tố theo thứ tự giảm dần: Si, Al, Mg.
HĐ
|
1. So sánh tính kim loại của sodium và magnesium Chuẩn bị: kim loại Na; Mg dung dịch phenolphthalein; nước; cốc thủy tinh. Tiến hành: - Lấy hai cốc thủy tinh, mỗi cốc có chứa khoảng 200 ml nước, nhỏ tiếp vài giọt dung dịch phenolphtalein. - Cho một mẩu nhỏ Na vào cốc (1), một dây Mg và cốc (2). Lưu ý:Hầu hết các kim loại kiềm phản ứng với nước mãnh liệt, chỉ sử dụng các kim loại kiềm với lượng nhỏ; cần làm sạch bề mặt dây Mg trước khi cho vào cốc (2). Quan sát hiện tượng và trả lời câu hỏi: 1. Viết phương trình hóa học của các phản ứng. 2. So sánh mức độ phản ứng của sodium và magnesium với nước. 2. So sánh tính phi kim của chlorine và iodine Chuẩn bị: Hình ảnh hoặc video phản ứng của nước chlorine với dung dịch potassium iodide. Tiến hành: Quan sát hình ảnh hoặc xem video phản ứng của nước chlorine với dung dịch potassium iodide. Câu hỏi: So sánh tính phi kim của chlorine và iodine.
|
Phương pháp giải:
1. Tiến hành thí nghiệm theo hướng dẫn và quan sát hiện tượng.
2. Quan sát tư liệu ( hình ảnh hoặc video) phản ứng của nước chlorine với dung dịch potassium iodide.
Lời giải chi tiết:
1. So sánh tính kim loại của sodium và magnesium
2Na + 2H2O 2NaOH + H2
2. Ở điều kiện thường:
- Sodium phản ứng mãnh liệt với nước, tạo dung dịch màu hồng và tỏa nhiệt.
- Magnesium không phản ứng với nước.
2. So sánh tính phi kim của chlorine và iodine
- Hiện tượng: Dung dịch không màu chuyển thành màu nâu của Iodine
=> Cl đẩy được I ra khỏi dung dịch KI => Tính phi kim của iodine yếu hơn chlorine
CH
|
Dựa vào bảng tuần hoàn các nguyên tố hóa học, sắp xếp các nguyên tố Ba, Mg, Ca, Sr theo thứ tự giảm dần tính kim loại và giải thích. |
Phương pháp giải:
Trong một nhóm, tính kim loại tăng theo chiều tăng của điện tích hạt nhân.
Lời giải chi tiết:
- Trong một nhóm, tính kim loại tăng theo chiều tăng của điện tích hạt nhân.
- Các nguyên tố Ba, Mg, Ca và Sr đều nằm ở nhóm IIA => Các nguyên tố được sắp xếp theo thứ tự giảm dần tính kim loại Ba, Sr, Ca, Mg.
CH
|
Trong các nguyên tố O, F, Cl Se, nguyên tố có tính phi kim mạnh nhất là A. O. B. F. C. Se. D. Cl. |
Phương pháp giải:
- Trong một nhóm, tính kim loại tăng và tính phi kim giảm theo chiều tăng của điện tích hạt nhân.
- Trong một chu kì, tính kim loại giảm và tính phi kim tăng theo chiều tăng của điện tích hạt nhân.
Lời giải chi tiết:
- Nguyên tố O và F nằm cùng một chu kì 2 => tính phi kim theo thứ tự tăng dần O, F
- Nguyên tố O và Se nằm cùng một nhóm => tính phi kim theo thứ tự tăng dần Se, O
- Nguyên tố F và Cl nằm cùng một nhóm => tính phi kim theo thứ tự tăng dần Cl, F
=> Nguyên tố có tính phi kim mạnh nhất trong các nguyên tố O,F, Cl, Se là F
Lý thuyết
Search google: "từ khóa + timdapan.com" Ví dụ: "Bài 6. Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố trong một chu kì và trong một nhóm trang 34, 35, 36, 37, 38, 39 Hóa 10 Kết nối tri thức timdapan.com"