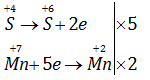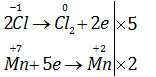Bài 17.11, 17.12, 17.13 trang 42 SBT Hóa học 10
Giải bài 17.11, 17.12, 17.13 trang 42 sách bài tập Hóa học 10. Cho dung dịch X chứa (KMnO_4) và (H_2SO_4) (loãng) lần lượt vào các dung dịch : (FeCl_2, FeSO_4, CuSO_4, MgSO_4, H_2S, HCl) (đặc). Số trường hợp có xảy ra phản ứng oxi hoá - khử là
Câu 17.11.
Cho dung dịch X chứa \(KMnO_4\) và \(H_2SO_4\) (loãng) lần lượt vào các dung dịch : \(FeCl_2, FeSO_4, CuSO_4, MgSO_4, H_2S, HCl\) (đặc). Số trường hợp có xảy ra phản ứng oxi hoá - khử là
A. 6. B. 4.
C. 3. D. 5
Phương pháp giải:
\(KMnO_4\) là chất có tính oxi hóa mạnh, xảy ra phản ứng với chất khử mạnh.
Giải chi tiết:
Các chất có tính khử: FeCl2, FeSO4, H2S, HCl
=> Chọn B
Câu 17.12.
Cho phản ứng :
\(N{a_2}S{O_3} + KMn{O_4} + NaHS{O_4} \to N{a_2}S{O_4} + MnS{O_4} + {K_2}S{O_4} + {H_2}O\)
Sau khi cân bằng tổng các hệ số của các chất (các số nguyên, tối giản) trong phương trình hoá học trên là
A. 23. B. 27.
C. 47. D. 31.
Phương pháp giải:
Xem lại cách cân bằng phản ứng oxi hóa - khử tại đây
\(5N{a_2}S{O_3} + 2KMn{O_4} + 6NaHS{O_4} \to 8N{a_2}S{O_4} + 2MnS{O_4} + {K_2}S{O_4} + 3{H_2}O\)
=> Tổng các hệ số là: 5 + 2 + 6 + 8 + 2 + 1 + 3 = 27
=> Chọn B
Câu 17.13.
Trong phòng thí nghiệm, khí clo được điều chế theo phản ứng :
\(KMn{O_4}\) + HCl (đặc)→\(KCl+ MnCl_2 + Cl_2↑ +H_2O\)
Để điều chế được 1 mol khí clo, số mol \(KMnO_4\) và HCl cần dùng lần lượt là
A. 0,2 và 2,4. B. 0,2 và 2,8.
C. 0,4 và 3,2. D. 0,2 và 4,0.
Phương pháp giải:
Cân bằng PTHH trên theo phương pháp thăng bằng electron tại đây
Tính toán theo phương trình hóa học.
Giải chi tiết:
2KMnO4 + 16HCl (đặc) → 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O
0,4 mol 3,2 mol ← 1 mol
=> Chọn C
Search google: "từ khóa + timdapan.com" Ví dụ: "Bài 17.11, 17.12, 17.13 trang 42 SBT Hóa học 10 timdapan.com"