Bài 10.3, 10.4 trang 17 SBT hóa học 11
Giải bài 10.3, 10.4 trang 17 sách bài tập hóa học 11. Hãy chọn nửa câu ở cột (II) ghép với nửa câu ở cột (I) để được câu phù hợp :...
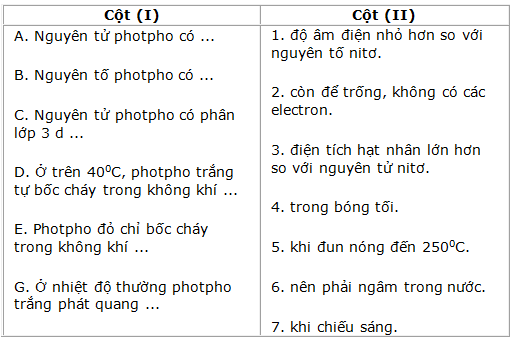
Câu 10.3.
Hãy chọn nửa câu ở cột (II) ghép với nửa câu ở cột (I) để được câu phù hợp :
Phương pháp: Xem lại lí thuyết về Photpho Tại đây
Lời giải: A - 3; B - 1; C-2; D-6; E-5; G-4.
Câu 10.4.
Đốt cháy hoàn toàn 6,2 g photpho trong oxi lấy dư. Cho sản phẩm tạo thành tác dụng với 150 ml dung dịch NaOH 2M. Sau phản ứng, trong dung dịch thu được có các muối :
A. NaH2PO4 và Na2HPO4
B. Na2HPO4 và Na3PO4
C. NaH2PO4 và Na3PO4
D. Na3PO4.
Phương pháp:
PTHH đốt photpho trong oxi lấy dư: 4P+5O2 \( \to \) 2P2O5
Tính nP => nP2O5
Xét tỉ lệ số mol NaOH và P2O5 : \(\dfrac{{{n_{NaOH}}}}{{{n_{{P_2}{O_5}}}}}\). Từ đó suy ra muối nào được tạo thành sau phản ứng.
Lời giải:
4P+5O2 \( \to \) 2P2O5 (1)
P2O5 + 2NaOH + H2O \( \to \) 2NaH2PO4 (2)
P2O5 + 4NaOH \( \to \) 2Na2HPO4 + H2O (3)
P2O5 + 6NaOH \( \to \) 2Na3PO4 + 3H2O (4)
Số mol photpho : nP = \(\dfrac{{6,2}}{{31}}\) = 0,2 (mol).
Số mol NaOH : nNaOH = \(\dfrac{{150.2}}{{1000}}\) = 0,3 (mol)
Sản phẩm tạo thành khi đốt photpho là P2O5.
Theo (1), số mol P2O5 = \(\dfrac{1}{2}\).nP = \(\dfrac{0,2}{2}\) =0,1 (mol).
Ti lệ số mol NaOH và P2O5 : \(\dfrac{{{n_{NaOH}}}}{{{n_{{P_2}{O_5}}}}} = \dfrac{{0,3}}{{0,1}} = 3\)
Tỉ lệ số mol nằm trong khoảng 2 và 4, do đó theo các phản ứng (2) và (3) trong dung dịch thu được có hai muối được tạo thành là NaH2PO4 và Na2HPO4.
=> Chọn A
Search google: "từ khóa + timdapan.com" Ví dụ: "Bài 10.3, 10.4 trang 17 SBT hóa học 11 timdapan.com"