Câu 8* trang 55 SGK Hóa học 11 Nâng cao
Xác định công thức của sunfua kim loại.
Đốt cháy hoàn toàn 4,4g một sunfua kim loại có công thức MS (Kim loại M có các số oxi hóa +2 và +3 trong các hợp chất) trong lượng dư oxi. Chất rắn thu được sau phản ứng hòa tan trong một lượng vừa đủ dung dịch \(HN{O_3}\) 37,8%. Nồng độ phần trăm của muối trong dung dịch thu được là 41,7%.
a) Xác định công thức của sunfua kim loại.
b) Tính khối lượng dung dịch \(HN{O_3}\)đã dùng.
Giải
a) Gọi khối lượng nguyên tử của M là M.
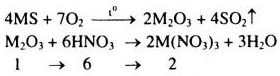
Xét 1 mol \({M_2}{O_3}\)
Khối lượng dung dịch \(HN{O_3}\) đã dùng: \({m_{{\rm{dd}}HN{O_3}}} = \frac{{6.63.100}}{{37,8}} = 1000(g)\)
Khối lượng dung dịch thu được sau phản ứng:
\({m_{{\rm{dd}}}} = {m_{{M_2}{O_3}}} + {m_{{\rm{dd}}HN{O_3}}} \)
\(= 1.(2M + 48) + 1000 = (2M + 1048)(g)\)
Khối lượng muối thu được sau phản ứng: \({m_{ct}} = {m_{M{{(N{O_3})}_3}}} = 2.(M + 186)(g)\)
Theo đề bài ta có: \({C_\% } = \frac{{{m_{ct}}.100}}{{m{\rm{dd}}}} \Rightarrow 41,7 = \frac{{2(M + 186).100}}{{2M + 1048}}\)
\( \Rightarrow M = 56g/mol(Fe)\)
b)
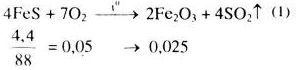
\(F{e_2}{O_3} + 6HN{O_3} \to 2Fe{(N{O_3})_3} + 3{H_2}O\) (2)
\(0,025 \to 0,15\)
Từ (1) và (2) \( \Rightarrow {n_{HN{O_3}}}\) = 0,15 mol
Khối lượng dung dịch \({HN{O_3}}\) 37,8% đã dùng là:
\({m_{{\rm{dd}}}} = \frac{{0,15.63.100}}{{37,8}} = 25(g)\)
Search google: "từ khóa + timdapan.com" Ví dụ: "Câu 8* trang 55 SGK Hóa học 11 Nâng cao timdapan.com"