Bài 42: Luyện tập Nhận biết một số chất vô cơ
Video bài giảng
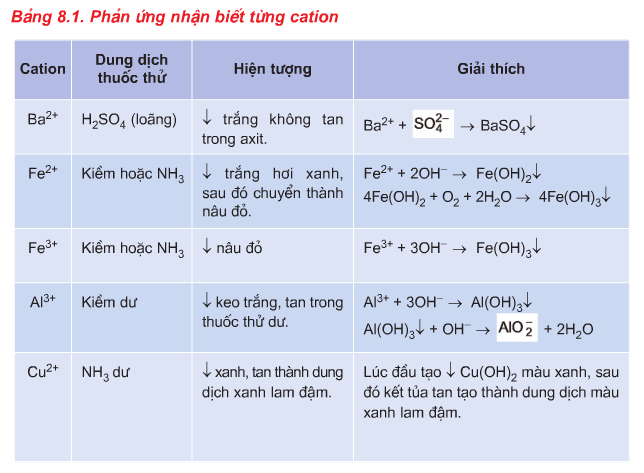
1. Phương pháp nhận biết Cation
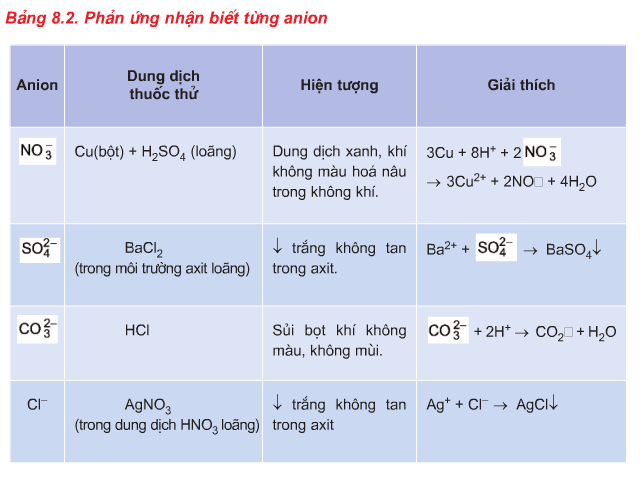
2. Phương pháp nhận biết Anion
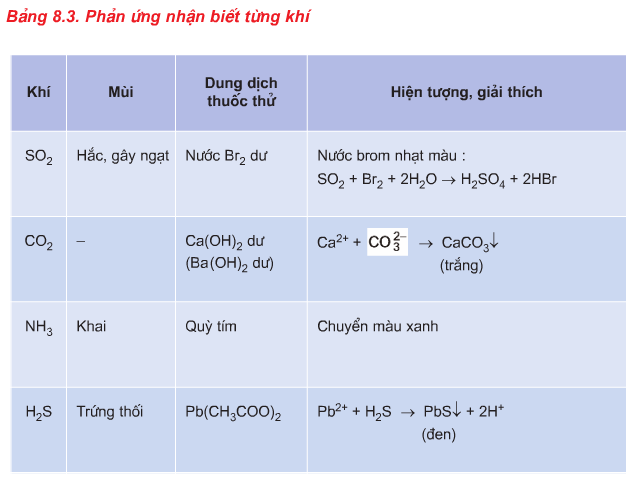
3. Phương pháp nhận biết chất khí
Bài tập Nhận biết một số chất vô cơ
Bài 1:
Có các dung dịch riêng biệt không dán nhãn: NH4Cl, AlCl3, FeCl3, (NH4)2SO4. Dung dịch thuốc thử cần thiết để nhận biết các dung dịch trên là:
Hướng dẫn:
Ion (OH)- tạo kết tủa hidroxit với ion kim loại → Nhận biết bằng màu sắc hidroxit. (Loại C, D)
Nhận xét dãy chất: NH4Cl, AlCl3, FeCl3, (NH4)2SO4
Nếu dùng Ba(OH)2 sẽ nhận biết
+NH4Cl : làm sủi bọt khí có mùi khai
Ba(OH)2 + 2NH4Cl → BaCl2 + 2NH3 + 2H2O
+AlCl3 : tạo kết tủa trắng sau đó kết tủa tan dần
3Ba(OH)2 + 2AlCl3 → BaCl2 + 2Al(OH)3
2Al(OH)3 + Ba(OH)2 → Ba(AlO2)2 + 4H2O
+FeCl3: tạo kết tủa nâu đỏ
2FeCl3 + 3Ba(OH)2 → 2Fe(OH)3 + 3BaCl2
+(NH4)2SO4 : tạo BaSO4 kết tủa trắng và thoát khí có mùi khai là NH3
Ba(OH)2 + (NH4)2SO4 → BaSO4 + 2NH3 + 2H2O
Bài 2:
Cho hai dd riêng biệt là Na2SO3 và K2CO3 . Cho các phương pháp nhận biết sau, hỏi phương pháp hóa học nào nhận biết nhanh và chính xác nhất?
(1) dd nước vôi trong dư
(2) đốt và quan sát ngọn lửa
(3) dd BaCl2
(4) dd nước brôm loãng
Hướng dẫn:
(1) Cả hai dd đều tạo ra kết tủa trắng
(2) Hợp chất của Na cho màu vàng , còn K cho ngọn lửa màu tím => Phương pháp vật lí (Loại)
(3) Cả hai dd đều tạo kết tủa trắng
(4) Na2SO3 +( HBr) Br2/H2O → NaBr + SO2 + H2O ,khí SO2 sinh ra mất màu nước brôm
K2CO3 + (HBr)Br2/H2O → NaBr + CO2 + H2O , khí sinh ra không làm mất màu nước brôm
1. Phương pháp nhận biết Cation
2. Phương pháp nhận biết Anion
3. Phương pháp nhận biết chất khí
Bài tập Nhận biết một số chất vô cơ
Bài 1:
Có các dung dịch riêng biệt không dán nhãn: NH4Cl, AlCl3, FeCl3, (NH4)2SO4. Dung dịch thuốc thử cần thiết để nhận biết các dung dịch trên là:
Hướng dẫn:
Ion (OH)- tạo kết tủa hidroxit với ion kim loại → Nhận biết bằng màu sắc hidroxit. (Loại C, D)
Nhận xét dãy chất: NH4Cl, AlCl3, FeCl3, (NH4)2SO4
Nếu dùng Ba(OH)2 sẽ nhận biết
+NH4Cl : làm sủi bọt khí có mùi khai
Ba(OH)2 + 2NH4Cl → BaCl2 + 2NH3 + 2H2O
+AlCl3 : tạo kết tủa trắng sau đó kết tủa tan dần
3Ba(OH)2 + 2AlCl3 → BaCl2 + 2Al(OH)3
2Al(OH)3 + Ba(OH)2 → Ba(AlO2)2 + 4H2O
+FeCl3: tạo kết tủa nâu đỏ
2FeCl3 + 3Ba(OH)2 → 2Fe(OH)3 + 3BaCl2
+(NH4)2SO4 : tạo BaSO4 kết tủa trắng và thoát khí có mùi khai là NH3
Ba(OH)2 + (NH4)2SO4 → BaSO4 + 2NH3 + 2H2O
Bài 2:
Cho hai dd riêng biệt là Na2SO3 và K2CO3 . Cho các phương pháp nhận biết sau, hỏi phương pháp hóa học nào nhận biết nhanh và chính xác nhất?
(1) dd nước vôi trong dư
(2) đốt và quan sát ngọn lửa
(3) dd BaCl2
(4) dd nước brôm loãng
Hướng dẫn:
(1) Cả hai dd đều tạo ra kết tủa trắng
(2) Hợp chất của Na cho màu vàng , còn K cho ngọn lửa màu tím => Phương pháp vật lí (Loại)
(3) Cả hai dd đều tạo kết tủa trắng
(4) Na2SO3 +( HBr) Br2/H2O → NaBr + SO2 + H2O ,khí SO2 sinh ra mất màu nước brôm
K2CO3 + (HBr)Br2/H2O → NaBr + CO2 + H2O , khí sinh ra không làm mất màu nước brôm