Bài 40: Nhận biết một số ion trong dung dịch
Video bài giảng
1. Nguyên tắc nhận biết ion trong dung dịch
- Dung dịch chứa ion + Thuốc thử:
+ Chất kết tủa
+ Sản phẩm có màu
+ Chất khí khó tan sủi bọt
+ Chất khí bay khỏi dung dịch
2. Nhận biết một số Cation trong dung dịch
a. Bảng nhận biết
- Na+: Thử màu ngọn lửa → Ngọn lửa có màu vàng tươi
- NH4+: Dung dịch kiềm → Tạo khí NH3 có mùi khai
- Ba2+ : Dung dịch H2SO4 dư → Kết tủa màu trắng
- Al3+: Dd kiềm hoặc NH3 → Kết tủa keo trắng tan trong OH- dư
- Fe3+ : Dung dịch kiềm → Kết tủa nâu đỏ
- Fe2+ : Dung dịch kiềm → Kết tủa trắng xanh→đỏ nâu
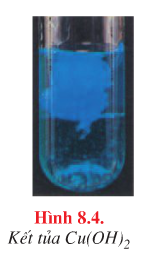
- Cu2+ : Dung dịch kiềm → Kết tủa xanh
b. Màu sắc của một số kết tủa
3. Nhận biết một số Anion trong dung dịch
a. Bảng nhận biết
- NO3-: Dung dịch Cu/H+ → Dd có màu xanh, khí thoát ra hóa nâu trong không khí.
- SO42-: Dung dịch Ba2+/H+ dư → Kết tủa trắng
- Cl-: Dung dịch AgNO3 → Kết tủa trắng
- CO32- : Dd axit mạnh/ Ca(OH)2 → Kết tủa trắng
4. Bài tập Nhận biết một số ion trong dung dịch - Cơ bản
Bài 1:
Có các dung dịch không màu đựng trong các lọ riêng biệt, không dán nhãn: ZnSO4, Cu(NO3)2, Al(NO3)3. Để phân biệt các dung dịch trên có thể dùng thuốc thử nào? Nêu các hiện tượng diễn ra.
Hướng dẫn:
Dùng dd Ba(OH)2 vì:
- ZnSO4 tạo kết tủa màu trắng.
Ba(OH)2 + ZnSO4 → BaSO4 + Zn(OH)2
- Cu(NO3)2 tạo kết tủa màu xanh.
Cu(NO3)2 + Ba(OH)2 → Cu(OH)2 + Ba(NO3)2
- Al(NO3)3 tạo kết tủa keo.
Al(NO3)3 + Ba(OH)2 → Al(OH)3 + Ba(NO3)2
Bài 2:
Trình bày cách nhận biết các dung dịch trong suốt, trong lọ mất nhãn sau: HCl,HNO3, H2SO4 bằng phương pháp hóa học?
Hướng dẫn:
Trích mỗi chất một ít cho vào 3 ống nghiệm khác nhau và đánh số thứ tự (1), (2), (3).
Lấy dung dịch BaCl2 cho vào 3 ống nghiệm, ống nào cho kết tủa trắng là H2SO4:
BaCl2 + H2SO4 → BaSO4 + 2HCl
Lấy dung dịch AgNO3 cho vào hai ống còn lại, ống nào cho kết tủa trắng sau hóa đen ngoài không khí là chứa axit HCl.
AgNO3 + HCl → HNO3 + AgCl
Dung dịch còn lại là HNO3.
Bài 3:
Dùng dung dịch Ba(OH)2 để phân biệt 6 dung dịch NaNO3, Fe(NO3)3, Al(NO3)3, Mg(NO3)2, NH4NO3, (NH4)2SO4 sau thì hiện tượng diễn ra là gì?
Hướng dẫn:
Fe(NO3)3 tạo kết tủa màu nâu đỏ.
Al(NO3)3 tạo kết tủa keo.
Mg(NO3)2 tạo kết tủa trắng.
NH4NO3 tạo khí mùi khai.
(NH4)2SO4 tạo kết tủa màu trắng đồng thời có khí mùi khai thoát ra.
5. Bài tập Nhận biết một số ion trong dung dịch - Nâng cao
Bài 1:
Có 5 dung dịch mất nhãn : Na2S, BaCl2, AlCl3, MgCl2, Na2CO3. Nếu không dùng thêm thuốc thử thì có thể nhận biết được tối đa số dung dịch là
Hướng dẫn:
Cho từng cặp chất trong bình phản ứng từng đôi một, ta có bảng sau:
.png)
Vậy có thể nhận biết cả 5 chất trong 5 lọ mất nhãn.
1. Nguyên tắc nhận biết ion trong dung dịch
- Dung dịch chứa ion + Thuốc thử:
+ Chất kết tủa
+ Sản phẩm có màu
+ Chất khí khó tan sủi bọt
+ Chất khí bay khỏi dung dịch
2. Nhận biết một số Cation trong dung dịch
a. Bảng nhận biết
- Na+: Thử màu ngọn lửa → Ngọn lửa có màu vàng tươi
- NH4+: Dung dịch kiềm → Tạo khí NH3 có mùi khai
- Ba2+ : Dung dịch H2SO4 dư → Kết tủa màu trắng
- Al3+: Dd kiềm hoặc NH3 → Kết tủa keo trắng tan trong OH- dư
- Fe3+ : Dung dịch kiềm → Kết tủa nâu đỏ
- Fe2+ : Dung dịch kiềm → Kết tủa trắng xanh→đỏ nâu
- Cu2+ : Dung dịch kiềm → Kết tủa xanh
b. Màu sắc của một số kết tủa
3. Nhận biết một số Anion trong dung dịch
a. Bảng nhận biết
- NO3-: Dung dịch Cu/H+ → Dd có màu xanh, khí thoát ra hóa nâu trong không khí.
- SO42-: Dung dịch Ba2+/H+ dư → Kết tủa trắng
- Cl-: Dung dịch AgNO3 → Kết tủa trắng
- CO32- : Dd axit mạnh/ Ca(OH)2 → Kết tủa trắng
4. Bài tập Nhận biết một số ion trong dung dịch - Cơ bản
Bài 1:
Có các dung dịch không màu đựng trong các lọ riêng biệt, không dán nhãn: ZnSO4, Cu(NO3)2, Al(NO3)3. Để phân biệt các dung dịch trên có thể dùng thuốc thử nào? Nêu các hiện tượng diễn ra.
Hướng dẫn:
Dùng dd Ba(OH)2 vì:
- ZnSO4 tạo kết tủa màu trắng.
Ba(OH)2 + ZnSO4 → BaSO4 + Zn(OH)2
- Cu(NO3)2 tạo kết tủa màu xanh.
Cu(NO3)2 + Ba(OH)2 → Cu(OH)2 + Ba(NO3)2
- Al(NO3)3 tạo kết tủa keo.
Al(NO3)3 + Ba(OH)2 → Al(OH)3 + Ba(NO3)2
Bài 2:
Trình bày cách nhận biết các dung dịch trong suốt, trong lọ mất nhãn sau: HCl,HNO3, H2SO4 bằng phương pháp hóa học?
Hướng dẫn:
Trích mỗi chất một ít cho vào 3 ống nghiệm khác nhau và đánh số thứ tự (1), (2), (3).
Lấy dung dịch BaCl2 cho vào 3 ống nghiệm, ống nào cho kết tủa trắng là H2SO4:
BaCl2 + H2SO4 → BaSO4 + 2HCl
Lấy dung dịch AgNO3 cho vào hai ống còn lại, ống nào cho kết tủa trắng sau hóa đen ngoài không khí là chứa axit HCl.
AgNO3 + HCl → HNO3 + AgCl
Dung dịch còn lại là HNO3.
Bài 3:
Dùng dung dịch Ba(OH)2 để phân biệt 6 dung dịch NaNO3, Fe(NO3)3, Al(NO3)3, Mg(NO3)2, NH4NO3, (NH4)2SO4 sau thì hiện tượng diễn ra là gì?
Hướng dẫn:
Fe(NO3)3 tạo kết tủa màu nâu đỏ.
Al(NO3)3 tạo kết tủa keo.
Mg(NO3)2 tạo kết tủa trắng.
NH4NO3 tạo khí mùi khai.
(NH4)2SO4 tạo kết tủa màu trắng đồng thời có khí mùi khai thoát ra.
5. Bài tập Nhận biết một số ion trong dung dịch - Nâng cao
Bài 1:
Có 5 dung dịch mất nhãn : Na2S, BaCl2, AlCl3, MgCl2, Na2CO3. Nếu không dùng thêm thuốc thử thì có thể nhận biết được tối đa số dung dịch là
Hướng dẫn:
Cho từng cặp chất trong bình phản ứng từng đôi một, ta có bảng sau:
.png)
Vậy có thể nhận biết cả 5 chất trong 5 lọ mất nhãn.
.PNG)
.PNG)
.PNG)