Bài 28: Luyện tập Tính chất của kim loại kiềm, kim loại kiềm thổ và hợp chất của chúng
Video bài giảng
1. Vị trí của kim loại kiềm, kiềm thổ trong Bảng hệ thống tuần hoàn và cấu hình electron
- Kim loại kiềm:
+ Vị trí trong bảng tuần hoàn: nhóm IA
+ Cấu hình electron lớp ngoài cùng: ns1
+ Tính chất hóa học đặc trưng: Có tính khử mạnh nhất trong các kim loại
M → M+ + e
+ Điều chế: Điện phân muối halogen nóng chảy
2MX (đpnc) → 2M + X2
- Kim loại kiềm thổ:
+ Vị trí trong bảng tuần hoàn: nhóm IIA
+ Cấu hình electron lớp ngoài cùng: ns2
+ Tính chất hóa học đặc trưng: Có tính khử mạnh chỉ sau kim loại kiềm
M → M2+ + 2e
+ Điều chế: MX2 (đpnc) → M + X2
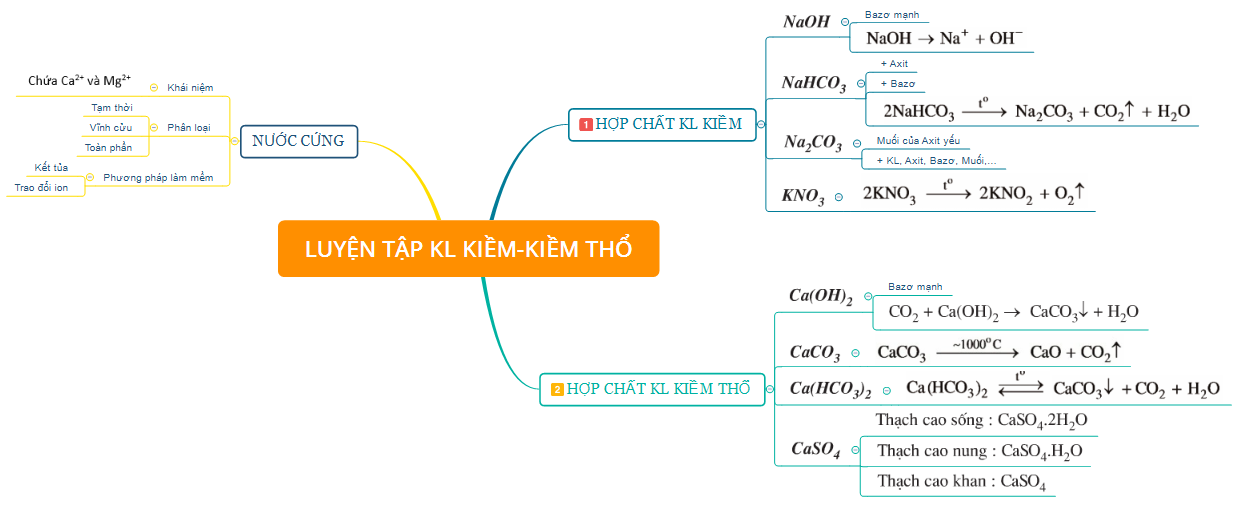
2. Một số hợp chất quan trọng của kim loại kiềm, kiềm thổ và Nước cứng
3. Bài tập Tính chất của kim loại kiềm, kim loại kiềm thổ và hợp chất của chúng - Cơ bản
Bài 1:
Hỗn hợp rắn A gồm Ca(HCO3); CaCO3; NaHCO3; Na2CO3. Nung A đến khối lượng không đổi được chất rắn B gồm:
Hướng dẫn:
Các muối hidrocacbonat của kim loại kiềm và kiềm thổ đều bị phân hủy tạo muối cacbonat khi ở nhiệt độ không quá cao, tuy nhiên chỉ có muối cacbonat của kim loại kiềm thổ mới bị thủy phân ở nhiệt độ cao tạo oxit kim loại.
⇒ Nhiệt phân hỗn hợp ban đầu sẽ thu được: CaO; Na2CO3.
Bài 2:
Cho các chất: Na2CO3; NaHCO3; NaHSO4; HCl; BaCl2; CuO; Fe. Số cặp chất có thể tác dụng trực tiếp với nhau ở nhiệt độ thường là:
Hướng dẫn:
Các cặp chất: (Na2CO3 + NaHSO4); (Na2CO3 + HCl); (Na2CO3 + BaCl2); (NaHCO3 + NaHSO4); (NaHCO3 + HCl); (NaHSO4 + BaCl2); (NaHSO4 + CuO); (NaHSO4 + Fe); (HCl + CuO); (HCl + Fe).
Bài 3:
Hoà tan hoàn toàn 14,52 gam hỗn hợp X gồm NaHCO3, KHCO3 và MgCO3 bằng dd HCl dư, thu được 3,36 lít khí CO2 (đktc) và dd chứa m gam muối KCl. Giá trị của m là:
Hướng dẫn:
Coi hỗn hợp gồm KHCO3 và MgCO3 có số mol lần lượt là x và y (vì MNaHCO3 = MMgCO3)
⇒ nCO2 = 0,15 mol ⇒ x + y = 0,15
Và 100x + 84y = 14,52
Suy ra x = 0,12 và y = 0,03
⇒ m = 0,12.(39 + 35,5) = 8,94 gam
4. Bài tập Tính chất của kim loại kiềm, kim loại kiềm thổ và hợp chất của chúng - Nâng cao
Bài 1:
Hấp thụ hoàn toàn 3,36 lít khí CO2 (đktc) vào dung dịch chứa 0,15 mol NaOH và 0,1 mol Ba(OH)2, thu được m gam kết tủa. Giá trị của m là:
Hướng dẫn:
Dạng toán CO2 tác dụng với hỗn hợp bazơ của kim loại nhóm kiềm – kiềm thổ.
\({{n_{C{O_2}}} = \frac{{3,36}}{{22,4}} = 0,15(mol)}\)
nOH- = nNaOH + 2.nBa(OH)2 = 0,15 + 2.0,2 = 0,25 mol
Vì: nCO2 < nOH- < 2nCO2 → nCO32- = nOH- - nCO2
\({n_{HC{O_3}^ - }} = {n_{C{O_2}}} - {n_{C{O_3}^{2 - }}}\)
\(\Rightarrow {n_{C{O_3}^{2 - }}} = 0,15mol\);
có \({n_{Ba{{\left( {OH} \right)}_2}}} = 0,1mol\)
\({n_{BaC{{\rm{O}}_3}}} = 0,1mol\)
Vậy \({m_{BaC{O_3}}} = 19,700g\)
Bài 2:
Hỗn hợp X gồm Na, Ba, Na2O và BaO. Hòa tan hoàn toàn 131,4 gam X vào nước, thu được 6,72 lít khí H2 (đktc) và dung dịch Y, trong đó có 123,12 gam Ba(OH)2. Hấp thụ hoàn toàn 40,32 lít khí CO2 (đktc) vào Y, thu được m gam kết tủa. Giá trị của m là:
Hướng dẫn:
Quy hỗn hợp X về Ba, Na và O.
nBa = nBa(OH)2 = 0,72 mol; nH2 = 0,3 mol
Đặt nNa = x (mol) , nO = y (mol)
BTKL: mNa + mO = mX - mBa ⇔ 23x + 16y = 32,76 (1)
BT electron: ne nhường = ne nhận
(ở đây Na, Ba nhường e, O nhận e về O2-, H+ nhận e thành H2 bay lên)
⇔ x + 2 .0,72 = 2y + 0,3. 2 (2)
Từ (1) và (2) ta có hệ phương trình:
\(\begin{array}{l}
\left\{ {\begin{array}{*{20}{l}}
{23x + 16y = 32,76\;\;}\\
{x{\rm{ - 2y}} = - 0,84}
\end{array}} \right.\\
\Leftrightarrow \left\{ {\begin{array}{*{20}{l}}
{x = 0,84}\\
{y = 0,84}
\end{array}} \right.
\end{array}\)
⇒ nOH- = nNa + 2nBa = 2,28 mol
nCO2 = 1,8 mol ⇒ nCO32- = 0,48 mol, nHCO3- = 1,32 mol
⇒ nBaCO3 = 0,48 mol
⇒ mBaCO3 = 94,56 gam
1. Vị trí của kim loại kiềm, kiềm thổ trong Bảng hệ thống tuần hoàn và cấu hình electron
- Kim loại kiềm:
+ Vị trí trong bảng tuần hoàn: nhóm IA
+ Cấu hình electron lớp ngoài cùng: ns1
+ Tính chất hóa học đặc trưng: Có tính khử mạnh nhất trong các kim loại
M → M+ + e
+ Điều chế: Điện phân muối halogen nóng chảy
2MX (đpnc) → 2M + X2
- Kim loại kiềm thổ:
+ Vị trí trong bảng tuần hoàn: nhóm IIA
+ Cấu hình electron lớp ngoài cùng: ns2
+ Tính chất hóa học đặc trưng: Có tính khử mạnh chỉ sau kim loại kiềm
M → M2+ + 2e
+ Điều chế: MX2 (đpnc) → M + X2
2. Một số hợp chất quan trọng của kim loại kiềm, kiềm thổ và Nước cứng
3. Bài tập Tính chất của kim loại kiềm, kim loại kiềm thổ và hợp chất của chúng - Cơ bản
Bài 1:
Hỗn hợp rắn A gồm Ca(HCO3); CaCO3; NaHCO3; Na2CO3. Nung A đến khối lượng không đổi được chất rắn B gồm:
Hướng dẫn:
Các muối hidrocacbonat của kim loại kiềm và kiềm thổ đều bị phân hủy tạo muối cacbonat khi ở nhiệt độ không quá cao, tuy nhiên chỉ có muối cacbonat của kim loại kiềm thổ mới bị thủy phân ở nhiệt độ cao tạo oxit kim loại.
⇒ Nhiệt phân hỗn hợp ban đầu sẽ thu được: CaO; Na2CO3.
Bài 2:
Cho các chất: Na2CO3; NaHCO3; NaHSO4; HCl; BaCl2; CuO; Fe. Số cặp chất có thể tác dụng trực tiếp với nhau ở nhiệt độ thường là:
Hướng dẫn:
Các cặp chất: (Na2CO3 + NaHSO4); (Na2CO3 + HCl); (Na2CO3 + BaCl2); (NaHCO3 + NaHSO4); (NaHCO3 + HCl); (NaHSO4 + BaCl2); (NaHSO4 + CuO); (NaHSO4 + Fe); (HCl + CuO); (HCl + Fe).
Bài 3:
Hoà tan hoàn toàn 14,52 gam hỗn hợp X gồm NaHCO3, KHCO3 và MgCO3 bằng dd HCl dư, thu được 3,36 lít khí CO2 (đktc) và dd chứa m gam muối KCl. Giá trị của m là:
Hướng dẫn:
Coi hỗn hợp gồm KHCO3 và MgCO3 có số mol lần lượt là x và y (vì MNaHCO3 = MMgCO3)
⇒ nCO2 = 0,15 mol ⇒ x + y = 0,15
Và 100x + 84y = 14,52
Suy ra x = 0,12 và y = 0,03
⇒ m = 0,12.(39 + 35,5) = 8,94 gam
4. Bài tập Tính chất của kim loại kiềm, kim loại kiềm thổ và hợp chất của chúng - Nâng cao
Bài 1:
Hấp thụ hoàn toàn 3,36 lít khí CO2 (đktc) vào dung dịch chứa 0,15 mol NaOH và 0,1 mol Ba(OH)2, thu được m gam kết tủa. Giá trị của m là:
Hướng dẫn:
Dạng toán CO2 tác dụng với hỗn hợp bazơ của kim loại nhóm kiềm – kiềm thổ.
\({{n_{C{O_2}}} = \frac{{3,36}}{{22,4}} = 0,15(mol)}\)
nOH- = nNaOH + 2.nBa(OH)2 = 0,15 + 2.0,2 = 0,25 mol
Vì: nCO2 < nOH- < 2nCO2 → nCO32- = nOH- - nCO2
\({n_{HC{O_3}^ - }} = {n_{C{O_2}}} - {n_{C{O_3}^{2 - }}}\)
\(\Rightarrow {n_{C{O_3}^{2 - }}} = 0,15mol\);
có \({n_{Ba{{\left( {OH} \right)}_2}}} = 0,1mol\)
\({n_{BaC{{\rm{O}}_3}}} = 0,1mol\)
Vậy \({m_{BaC{O_3}}} = 19,700g\)
Bài 2:
Hỗn hợp X gồm Na, Ba, Na2O và BaO. Hòa tan hoàn toàn 131,4 gam X vào nước, thu được 6,72 lít khí H2 (đktc) và dung dịch Y, trong đó có 123,12 gam Ba(OH)2. Hấp thụ hoàn toàn 40,32 lít khí CO2 (đktc) vào Y, thu được m gam kết tủa. Giá trị của m là:
Hướng dẫn:
Quy hỗn hợp X về Ba, Na và O.
nBa = nBa(OH)2 = 0,72 mol; nH2 = 0,3 mol
Đặt nNa = x (mol) , nO = y (mol)
BTKL: mNa + mO = mX - mBa ⇔ 23x + 16y = 32,76 (1)
BT electron: ne nhường = ne nhận
(ở đây Na, Ba nhường e, O nhận e về O2-, H+ nhận e thành H2 bay lên)
⇔ x + 2 .0,72 = 2y + 0,3. 2 (2)
Từ (1) và (2) ta có hệ phương trình:
\(\begin{array}{l}
\left\{ {\begin{array}{*{20}{l}}
{23x + 16y = 32,76\;\;}\\
{x{\rm{ - 2y}} = - 0,84}
\end{array}} \right.\\
\Leftrightarrow \left\{ {\begin{array}{*{20}{l}}
{x = 0,84}\\
{y = 0,84}
\end{array}} \right.
\end{array}\)
⇒ nOH- = nNa + 2nBa = 2,28 mol
nCO2 = 1,8 mol ⇒ nCO32- = 0,48 mol, nHCO3- = 1,32 mol
⇒ nBaCO3 = 0,48 mol
⇒ mBaCO3 = 94,56 gam