Bài 9: Amin
Video bài giảng
1. Khái niệm, phân loại và danh pháp Amin
a. Khái niệm, phân loại
- Khi thay thế nguyên tử H trong phân tử NH3 bằng gốc hidrocacbon ta thu được Amin.
- Amin thường có đồng phân về mạch Cacbon, về vị trí nhóm chức và về bậc Amin.
- Phân loại:
+ Theo gốc hidrocacbon:
- Amin mạch hở: CH3NH2 (Metylamin), C2H5NH2 (Etylamin),...
- Amin thơm: C6H5NH2 (Phenylamin),...
+ Theo bậc của Amin ( Bậc amin thường được tính bằng số gốc hidrocacbon liên kết với nguyên tử N):
- Amin bậc I: CH3NH2, C2H5NH2, ...
- Amin bậc II: CH3-NH-CH3
- Amin bậc III: CH3N(CH3)CH3
b. Danh pháp
- Danh pháp gốc - chức: tên gốc Hidrocacbon + amin
- Ví dụ: CH3-NH-CH3 (Đimetylamin); (CH3)3N (Trimetylamin); ...
2. Tính chất vật lí của Amin
- Metyl-, đimetyl-, trimetyl- và etylamin là những chất khí mùi khai, độc, dễ tan trong nước. Các amin đồng đẳng cao hơn là chất lỏng hoặc rắn.
- Anilin là chất lỏng, rất độc, nhiệt độ sôi 184oC, ít tan trong nước, tan trong ancol…
- Các Amin đều độc.
3. Cấu tạo phân tử và tính chất hóa học của Amin
a. Cấu tạo phân tử
- Amin có tính bazơ và dễ bị oxi hóa tương tự NH3.
- Amin còn có tính chất của gốc hidrocacbon.
b. Tính chất hóa học
- Tính bazơ: Dung dịch Metylamin hoặc Propylamin làm màu quỳ chuyển xanh, còn Anilin thì quỳ tím không đổi màu.
CH3CH2CH2NH2 + H2O ⇔ [CH3CH2CH2NH3]+ + OH-
CH3NH2 + HCl → [CH3NH3]Cl (metylamoni clorua)
- Tính bazơ của amin phụ thuộc mật độ e trên nguyên tử N: mật độ e lớn, tính bazơ mạnh
+ Gốc HC đẩy e làm tăng tính bazơ
+ Gốc hút e làm giảm tính bazơ
+ Amin béo > NH3 > amin thơm
+ Amin béo bậc II > amin béo bậc I
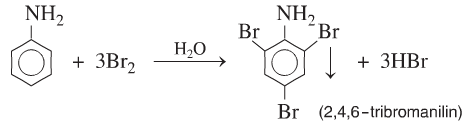
- Phản ứng thế ở nhân thơm của Anilin:
4. Bài tập Amin - Cơ bản
Bài 1:
Viết đồng phân amin bậc 1 có công thức C4H11N
Hướng dẫn:
Amin bậc 1 của C4H11N có 4 đồng phân:
\(C - C - C - C - N{H_2}\)
\(C - C - C\left( {N{H_2}} \right) - C\)
\(C - C\left( {C{H_3}} \right) - C - N{H_2}\)
\({\left( {C{H_3}} \right)_3} - C - N{H_2}\)
Bài 2:
Sắp xếp tăng dần tính bazơ của các chất ở dãy sau: NH3, C6H5NH2, CH3NHCH3, CH3CH2NH2.
Hướng dẫn:
- Dựa vào Gốc amin: Gốc đẩy e < NH3< Gốc hút e
C6H5NH2 < NH3 < CH3CH2NH2 ,CH3NHCH3
- Dựa vào bậc Amin: Bậc 3< Bậc 2 < Bậc 1< NH3
CH3CH2NH2 < CH3NHCH3
⇒ C6H5NH2 < NH3 < CH3CH2NH2 < CH3NHCH3
Bài 3:
Cho 9,3 gam anilin tác dụng với brom dư thì thu được m gam kết tủa. Giá trị của m là:
Hướng dẫn:
C6H5NH2 + 3Br2 → C6H2NH2(Br)3↓ + 3HBr
⇒ mkết tủa = 33 g
Bài 4:
Amin X đơn chức. Cho 0,1 mol X phản ứng hoàn toàn với lượng dư dung dịch HCl, thu được 8,15 gam muối. %mC trong X có giá trị là:
Hướng dẫn:
RNH2 + HCl → RNH3Cl
⇒ namin = nmuối = 0,1 mol
⇒ Mmuối = 81,5g ⇒ R = 29 (C2H5)
Amin là C2H5NH2
⇒ %mC(X) = 53,33%
5. Bài tập Amin - Nâng cao
Bài 1:
Cho 20 gam hỗn hợp gồm 3 amin no, đơn chức, là đồng đẳng liên tiếp của nhau tác dụng vừa đủ với dung dịch HCl, cô cạn dung dịch thu được 31,68 gam hỗn hợp muối. Nếu 3 amin trên trộn theo tỷ lệ số mol 1 : 10 : 5 và thứ tự phân tử khối tăng dần thì công thức phân tử của 3 amin là
Hướng dẫn:
\(C_{\bar{n}}H_{2\bar{n}+3}N+HCl\rightarrow C_{\bar{n}}H_{2\bar{n}+3}NHCl\)
a → a → a
\(a=\frac{31,68-20}{36,5}=0,32(mol)\)
\(\bar{M}=\frac{20}{0,32}=14\bar{n}+17\)
\(\bar{n}=3,25\)
nC có amin (I) 1mol
(n+1) (II) 10mol
(n+2) (III) 5mol
\(\bar{n}=3,25=\frac{n.1+(n+1)10+(n+2)5}{16}\Rightarrow n=2\)
C2H7N, C3H9N, C4H11N
1. Khái niệm, phân loại và danh pháp Amin
a. Khái niệm, phân loại
- Khi thay thế nguyên tử H trong phân tử NH3 bằng gốc hidrocacbon ta thu được Amin.
- Amin thường có đồng phân về mạch Cacbon, về vị trí nhóm chức và về bậc Amin.
- Phân loại:
+ Theo gốc hidrocacbon:
- Amin mạch hở: CH3NH2 (Metylamin), C2H5NH2 (Etylamin),...
- Amin thơm: C6H5NH2 (Phenylamin),...
+ Theo bậc của Amin ( Bậc amin thường được tính bằng số gốc hidrocacbon liên kết với nguyên tử N):
- Amin bậc I: CH3NH2, C2H5NH2, ...
- Amin bậc II: CH3-NH-CH3
- Amin bậc III: CH3N(CH3)CH3
b. Danh pháp
- Danh pháp gốc - chức: tên gốc Hidrocacbon + amin
- Ví dụ: CH3-NH-CH3 (Đimetylamin); (CH3)3N (Trimetylamin); ...
2. Tính chất vật lí của Amin
- Metyl-, đimetyl-, trimetyl- và etylamin là những chất khí mùi khai, độc, dễ tan trong nước. Các amin đồng đẳng cao hơn là chất lỏng hoặc rắn.
- Anilin là chất lỏng, rất độc, nhiệt độ sôi 184oC, ít tan trong nước, tan trong ancol…
- Các Amin đều độc.
3. Cấu tạo phân tử và tính chất hóa học của Amin
a. Cấu tạo phân tử
- Amin có tính bazơ và dễ bị oxi hóa tương tự NH3.
- Amin còn có tính chất của gốc hidrocacbon.
b. Tính chất hóa học
- Tính bazơ: Dung dịch Metylamin hoặc Propylamin làm màu quỳ chuyển xanh, còn Anilin thì quỳ tím không đổi màu.
CH3CH2CH2NH2 + H2O ⇔ [CH3CH2CH2NH3]+ + OH-
CH3NH2 + HCl → [CH3NH3]Cl (metylamoni clorua)
- Tính bazơ của amin phụ thuộc mật độ e trên nguyên tử N: mật độ e lớn, tính bazơ mạnh
+ Gốc HC đẩy e làm tăng tính bazơ
+ Gốc hút e làm giảm tính bazơ
+ Amin béo > NH3 > amin thơm
+ Amin béo bậc II > amin béo bậc I
- Phản ứng thế ở nhân thơm của Anilin:
4. Bài tập Amin - Cơ bản
Bài 1:
Viết đồng phân amin bậc 1 có công thức C4H11N
Hướng dẫn:
Amin bậc 1 của C4H11N có 4 đồng phân:
\(C - C - C - C - N{H_2}\)
\(C - C - C\left( {N{H_2}} \right) - C\)
\(C - C\left( {C{H_3}} \right) - C - N{H_2}\)
\({\left( {C{H_3}} \right)_3} - C - N{H_2}\)
Bài 2:
Sắp xếp tăng dần tính bazơ của các chất ở dãy sau: NH3, C6H5NH2, CH3NHCH3, CH3CH2NH2.
Hướng dẫn:
- Dựa vào Gốc amin: Gốc đẩy e < NH3< Gốc hút e
C6H5NH2 < NH3 < CH3CH2NH2 ,CH3NHCH3
- Dựa vào bậc Amin: Bậc 3< Bậc 2 < Bậc 1< NH3
CH3CH2NH2 < CH3NHCH3
⇒ C6H5NH2 < NH3 < CH3CH2NH2 < CH3NHCH3
Bài 3:
Cho 9,3 gam anilin tác dụng với brom dư thì thu được m gam kết tủa. Giá trị của m là:
Hướng dẫn:
C6H5NH2 + 3Br2 → C6H2NH2(Br)3↓ + 3HBr
⇒ mkết tủa = 33 g
Bài 4:
Amin X đơn chức. Cho 0,1 mol X phản ứng hoàn toàn với lượng dư dung dịch HCl, thu được 8,15 gam muối. %mC trong X có giá trị là:
Hướng dẫn:
RNH2 + HCl → RNH3Cl
⇒ namin = nmuối = 0,1 mol
⇒ Mmuối = 81,5g ⇒ R = 29 (C2H5)
Amin là C2H5NH2
⇒ %mC(X) = 53,33%
5. Bài tập Amin - Nâng cao
Bài 1:
Cho 20 gam hỗn hợp gồm 3 amin no, đơn chức, là đồng đẳng liên tiếp của nhau tác dụng vừa đủ với dung dịch HCl, cô cạn dung dịch thu được 31,68 gam hỗn hợp muối. Nếu 3 amin trên trộn theo tỷ lệ số mol 1 : 10 : 5 và thứ tự phân tử khối tăng dần thì công thức phân tử của 3 amin là
Hướng dẫn:
\(C_{\bar{n}}H_{2\bar{n}+3}N+HCl\rightarrow C_{\bar{n}}H_{2\bar{n}+3}NHCl\)
a → a → a
\(a=\frac{31,68-20}{36,5}=0,32(mol)\)
\(\bar{M}=\frac{20}{0,32}=14\bar{n}+17\)
\(\bar{n}=3,25\)
nC có amin (I) 1mol
(n+1) (II) 10mol
(n+2) (III) 5mol
\(\bar{n}=3,25=\frac{n.1+(n+1)10+(n+2)5}{16}\Rightarrow n=2\)
C2H7N, C3H9N, C4H11N